电解槽和电解
电能在大量化学反应中起着重要作用。从自发化学反应过程中释放的能量产生电能并利用电能完成非自发化学变化的科学领域称为电化学。
这些类型的过程的基础是氧化还原反应,我们在上一课中已经学习过。大量的化学和生物反应都是氧化还原反应。它们用于为家庭、运输或工业目的获取能量,燃烧燃料以消化动物的食物;光合作用从太阳中获取能量、从矿石中提取金属和制造重要化学品、运行干电池和湿电池、燃料电池等的几个工业过程。
反应通过电化学方式进行,可能节能且污染较少。因此,电化学的研究对于创造新的环保技术具有重要意义。因此,电化学是一门非常庞大的跨学科学科。氧化还原反应使我们活着。
电解槽
Electrolysis is the procedure of decomposition of an electrolyte by the passage of electricity throughout its aqueous solution or the molten state of an electric current. This cell is utilized to perform electrolysis which is electrolyte cells.
例如,水可以被电解(在电解池的帮助下)以产生气态氧和氢。这是通过利用电子流(进入反应环境)来克服非自发氧化还原反应的活化能垒来实现的。
以下是电解槽的三个主要组成部分:
- 阴极(电解池带负电)
- 阳极是一种阳极(对电解池带正电)
- 电解质:电解质充当电子在阴极和阳极之间流动的管道。水(含有溶解的离子)和熔融氯化钠是电解池中常见的电解质。
电解槽的工作
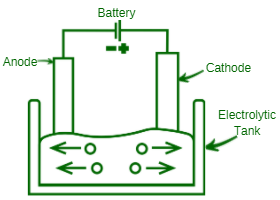
电解工作
- 电解过程是通过将电解质溶液放入合适的容器中来完成的。该容器称为电解槽。它由玻璃或不导电的材料制成。两根金属棒或金属板悬浮在电解液中。这些在金属线的帮助下连接到电池的端子。这些金属棒或金属板允许电流流动,称为电极。与电池正极相连的电极称为阳极,而与电池负极相连的电极称为阴极。
- 当电解质溶解在水中时,它会分裂成负离子和正离子。带正电的离子称为阳离子,带负电的离子称为阴离子。在整个溶液中通过电流。离子被带相反电荷的电极所吸引。因此,阳离子向阴极移动,而阴离子向阳极移动。溶液中离子的这种运动称为电解或离子传导,是电流通过溶液的流动。
- 到达阳极后,离子放弃它们的电子(从溶液中排出)。相反,阳离子在阴极占据电子。因此,阳离子和阴离子再次在电极处放电并转化为中性粒子。这被称为主要变化。初级产物可以以这种方式聚集,或者它们可以进一步转化为分子或化合物。这些被称为二次产品,变化被称为二次变化。
- 用电离原理解释电解过程。根据离子理论,电解质在溶液中以离子的形式存在,电的函数只是将这些离子引向各自的电。电解质只能在溶解或熔融状态下进行电解。
- 其中一个简单的电解池由两根浸入硫酸铜水溶液中的铜棒组成。当向两个电极施加电流(直流电压)时,Cu 2+离子在 cat(带负电的电极)处放电,并发生以下反应 -
在阴极:
Cu 2+ (aq) + 2e – ⇒ Cu(s)
- 铜金属沉积在阴极。在模式下,铜通过反应转化为 Cu 2+
Cu(s) ⇒ Cu 2+ (aq) + 2e –
- 因此,铜在阳极溶解。在氧化和还原方面,我们可以说铜在阳极被氧化,而在阴极被还原。它们是重要工业过程的基础,其中不纯的铜与许多其他金属(如 Na、Mg、Al 等)一起转化为高纯度铜,它们还通过各自阳离子的电化学还原大规模生成,其中没有合适的化学还原剂可用于还原。这是冶金中的重要方法之一。
- 举例来说,钠和镁金属是通过电解它们的熔融氯化物来生产的,而铝是通过在麦角灵(Na 3 AIF 6 )的存在下电解氧化铝来生产的。
电解
The cell which converts electrical energy into chemical energy is called an electrolytic cell. This oxidation occurs at the anode and is a positive plate while reduction occurs at the cathode and is a negative plate. In electrolytic cells, electrical energy is used to perform non-spontaneous chemical reactions and the process that takes place in an electrolytic cell is called electrolysis.
NaCl溶液的电解
由于水的电离和 NaCl 的存在,Na + 、Cl – 、H +和 OH –离子存在于 NaCl 的水溶液中。水的离子数量很低,因为它是一种弱电解质。当在反应过程中达到两个电极之间的电位差时,Na +和 H +离子向负极移动,即阴极,而 Cl -和 OH -离子向正极移动,即阳极。
在阴极的 H +和 Na +离子之间,H+ 离子被释放,但在同一地面上,Cl -离子优先于 OH -离子释放。
NaCl ⇌ Na + + Cl –
H 2 O ⇌ H + + OH –
在阴极:
- H + + e - → H
- 2H → H 2
在阳极:
- 氯– → 氯 + e –
- 2Cl → Cl 2
结果,Na +和 OH -离子在水溶液中保持不受干扰,当溶液蒸发时导致 NaOH 晶体。
法拉第电解定律
法拉第第一电解定律
在电解过程中通过电流到任何电极所表现出的化学反应量与流过电解质(溶液或熔融状态)的电量成正比。
w ∝ Q
Q = ZQ
w = Zit
where,
- Q = quantity of electricity
- t = current (A),
- t = time (sec),
- Z=constant proportionality called electrochemical equivalent.
法拉第第二电解定律
使用电解液可以通过相同电量的解离物质的量与其化学当量质量成正比,即-
W1/E1 = W2/E2 = W3/ E3 …….
where
- W1 = mass of substance 1 deposited
- E1 = equivalent weight
电解的应用
- 烧碱是由氯化钠溶液电解制成的
- O 2和H 2的制造
- 治疗恳求
- 电冶金
示例问题
问题1. 40.5g铝需要多少库仑才能反应,当电极为:
铝3+ + 3e – ⇒ 铝
解决方案:
1 mol of Al requires 3 mol of electrons or 3 × 96500 C
1 mol of Al = 27g
27g of Al require =3 × 96500 C
40.5g of Al require =(3*96500C × 40.5)/27 = 434,250 C
问题 2. 在酸性水的电解中,希望在 STP 位置以 1cc sec 获得氢气。当前的通行证应该是什么?
解决方案:
2H+ + 2e– ⇒ H2
1 mol of H2 or 22400 cc of H2 at STP requires = 2 × 96500 C
1cc of H2 at NTP requires = (2×96500)/22400 = 8.616 C
Now, Q = I × t
I = Q/t = 8.616/1s
= 8.616 ampere
问题 3. 电流为 2.00 A 的电流隔离 1.0 M Hg(NO 3 ) 2溶液 3 小时会产生多少摩尔汞?
解决方案:
Hg2+ + 2e– ⇒ Hg
Quality of electricity passed = I × t(sec)
= 2.0 A × 3.0 × 60 × 60 = 21600 C
2 × 96500 C of electricity produce mercury = 1 mol
21600 C of electricity will produce mercury = 1× 21600 / (2×96500) = 0.112mol
问题 4. 用 1.5 安培的电流电解 CuSO 溶液 10 分钟。沉积在阴极的铜的质量是多少?
解决方案:
Current strength (I) = 1.5 A
Time (t) = 10 min = 10 x 60 = 600s
amount of electricity passed = I x t = (1.5 A) x (600 s) = 900 C (A s = C)
Copper is deposited as: Cu +2e7 → Cu(s)
2 mol of electrons or 2 x 96500 C of current deposit copper = 63.56 g
900 C of current will deposit copper = 63.56/(2 ×96500) = 0.296 g
问题 5. 计算当 1.25 A 的电流流过硫酸铬 (III) 溶液时沉积 1.0 g 铬需要多长时间。 (Cr的摩尔质量=62)。
解决方案:
Cr3++3e– → Cr(s)
3 mol of electricity are needed to deposit 1 mol of Cr,
52 g of Cr require current = 3 x 96500 C
1g of Cr will require current = (3 x 96500)/52 =5567.3 C
number of coulombs = Current x t
Time (s) required = No. of coulombs / Current
Time (s) required = 5567.3 C / 1.25 (Ampere)
= 4453.8s or 1.24hr
问题 6. 用 2.0 A 电流将 3 mol 还原为 Fe 需要多少小时? (F= 96500 C) 解决方案:将 Fe³ + 还原为 Fe² + 。
解决方案:
Fe3+ +e– →Fe²+
Reduction of 1 mol of Fe3+ requires = 96500 C
Reduction of 3 mol of Fe³+ require = 3 × 96500 C = 2.895 x 10°C
Quantity of electricity = Current × Time
2.895 x 10 = 2 x Time
Time = 2.895×105 = 14475×105 s
Time= (14475 x 105 )/(60 x 60) = 40.21 hours