磷的含氧酸
含氧酸是含氧的酸。磷就是这样一种元素,可用于制造各种含氧酸。 H 3 PO 4 、H 3 PO 3和其他常见的含氧酸磷原子在磷含氧酸中被其他原子四面体包围。一般来说,很明显这些酸至少有一个 P=O 键和一个 P-OH 键。除了 P=O 和 P-OH 键外,磷含氧酸还具有 P-P 或 P-H 键。在这些情况下,磷的氧化态小于+5。已知这些酸会在较高和较低氧化态之间反弹。例如,当加热时,亚磷酸分解成磷酸和膦。
含氧酸中的 PH 键不能电离以产生 H +离子。另一方面,以 P-OH 形式与氧键合的 H 原子是可电离的。因此,我们可以说碱性是 H 原子与氧结合所表现出的特征。由于两个 P-OH 键,亚磷酸 H 3 PO 3是二元酸。类似地,磷酸 H 3 PO 4由于存在三个 P-OH 键而具有三碱基。具有 PH 键的磷含氧酸具有显着的还原能力。具有两个 PH 键的次磷酸是一种极好的还原剂。
4AgNO 3 + 2H 2 O + H 3 PO 2 → 4Ag + 4HNO 3 + H 3 PO 4
磷的含氧酸
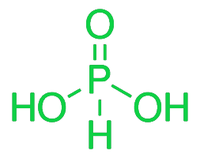
- 磷酸,H 3 PO 3
二质子酸是磷酸。因此,它使两个质子电离。结构式 HPO(OH) 2是一种更好的表示方式。亚磷酸可由三氯化磷用酸或蒸汽水解制得。
PCl 3 + 3H 2 O → HPO(OH) 2 + 3HCl
磷酸
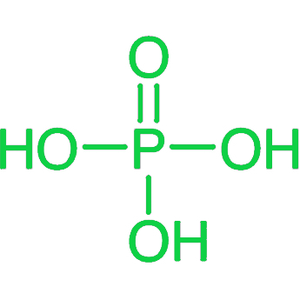
- 磷酸,H 3 PO 4
磷酸被归类为三元酸。这表明它具有电离三个质子的能力。纯净时,它是一种无毒酸。在室温和压力下,它是固体。磷酸三钙中加入硫酸可制取磷酸:
Ca 5 (PO 4 ) 3 X + 5H 2 SO 4 + 10H 2 O → 3H 3 PO 4 + 5CaSO 4 .2H 2 O + HX
(X 可以是 F、Cl、Br 和 OH)
磷酸
- 偏磷酸 (HPO 3 ) n
我们可以通过在摄氏850度左右加热正磷酸来得到它。作为单体,它不存在。它以环状三聚体、环状四聚体或聚合物的形式出现。
H 3 PO 4 → HPO 3 + H 2 O
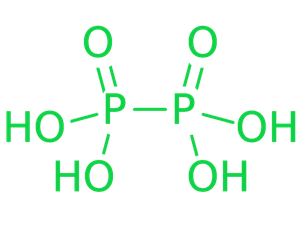
- 次磷酸(H 4 P 2 O 6 )
通过用亚氯酸钠对红磷进行受控氧化,形成次磷酸。一旦生成酸的二钠盐,它就会通过阳离子交换剂产生次磷酸。该酸本质上是四元酸。
2P + 2NaClO 2 + 2H 2 O → Na 2 H 2 P 2 O 6 + 2HCl
Na 2 H 2 P 2 O 6 + 2H → H 4 P 2 O 6 + 2Na
次磷酸
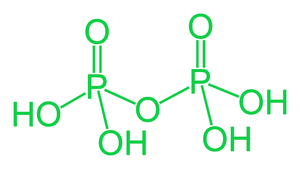
- 焦磷酸 (H 4 P 2 O 7 )
当正磷酸加热到接近 250°C 时,它会转变为四元酸。
2H 3 PO 4 → H 4 P 2 O 7 + H 2 O
焦磷酸
- 正磷酸 (H 3 PO 4 )
当用气泡水处理 P 4 O 10时,会产生正磷酸。该酸具有三元结构。
P 4 O 10 +6H 2 O → 4H 3 PO 4
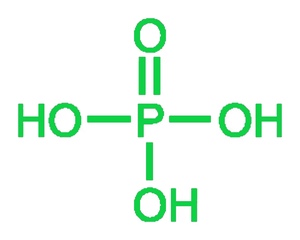
正磷酸
酸性强度
Acidic strength order of the Oxoacids of Phosphorus: H₃PO₂, H₃PO₃, and H₃PO₄
The order of phosphorus acidity strength of oxoacids: H3PO4 > H3PO3 > H3PO2.
在第一个例子中,所有氢原子都连接到一个氧原子作为 OH 基团,这使得氢很容易以质子的形式释放。因此,含磷含氧酸的酸度最高。在第二种情况下,两个氢原子与氧原子键合,而第三个氢原子与 P 原子相连,不能作为质子释放。
最后,在第三种情况下,只有一个氢原子与氧结合,而另外两个氢原子直接连接到 P 上,而 P 不能以质子的形式出现。此外,只能产生一个氢作为质子。因此,质子酸的酸度取决于该物质释放 H+ 离子的难易程度。结果,上述顺序就是结果。
基础力量
含磷含氧酸的碱度定义为该酸中可电离的 H +离子或质子的数量。尽管磷含氧酸的结构包含三个 H 原子,但只有那些直接与氧 (O) 原子相连的原子才容易电离。然而,只有两个这样的 H 原子。因此,磷含氧酸的碱度为 3。
磷的含氧酸的用途
磷含氧酸的众多应用包括:
- 磷在 HI 和 HBr 的生产中用作硫酸替代品。
- 它用于制造软饮料作为酸味剂。
- 它用于生产磷酸钠、磷酸铵和磷酸钾盐。
- 它用于生产磷肥。
示例问题
问题1:我们如何获得次磷酸?
回答:
The controlled oxidation of red phosphorus with sodium chlorite can produce this acid. When we obtain the hypophosphoric acid disodium salt, we run it via a cation exchanger to obtain hypophosphoric acid. It has a tetrabasic structure.
问题2:H 3 PO 2是酸吗?
回答:
If we look at the structure of Phosphorus Oxoacids, we can see that P is attached to an oxygen atom with a double bond, two hydrogens with every single bond, and finally to a hydroxyl group. Acids are organic substances that can produce free H+ ions. There are three hydrogens in the chemical described above. The basicity here is 2, but the hydrogen connected to the electronegative atom, to the oxygen atom, is transferred as a hydrogen ion. This could lead to confusion. Because P-H bonds are stronger than O-H bonds in this case, the weaker link is easily broken. This chemical is definitely an acid because it can produce an H+ ion.
问题 3:什么是含氧酸?
回答:
To put it simply, oxyacids are acids that contain oxygen. One of these elements is phosphorus, which can be found in a variety of oxoacids. Examples include H3PO4, H3PO3, and various oxyacids.
问题4:为什么H 3 PO 3是二元的?
回答:
The phosphorus atom is connected by two -OH groups, and one hydrogen atom is bonded directly to the phosphorus atom. It is simple to break the O-H bond. As a result, the two -OH groups are responsible for this compound’s diprotic nature. Whereas another Hydrogen is directly connected to the phosphorus atom, the bond is difficult to break due to its high stability. As a result, it is a diprotic acid rather than a triprotic acid.
问题5:写一个关于磷含氧酸的基本强度的简短说明?
回答:
The number of ionizable H+ ions or protons in phosphorus oxoacids is defined as the acid’s basicity. Although Phosphorus Oxoacids have three H atoms in their structure, only those immediately connected to the Oxygen (O) atom are easily ionised. There are, however, only two such H atoms. As a result, phosphorus oxoacids have a basicity of 3.