碱金属化合物的特性
我们周围有大量元素具有不同的属性和基于这些属性的不同用途。为了使用这些元素,属性很重要,因此应该有一些表格来对这些元素进行分组。该表被称为元素周期表,它是通过使用不同科学家的工作创建的。第一组元素称为碱金属。该组包含以下元素锂、钠、钾、铷、铯和钫。除锂外,所有其他元素的化学和物理性质都遵循类似的趋势。
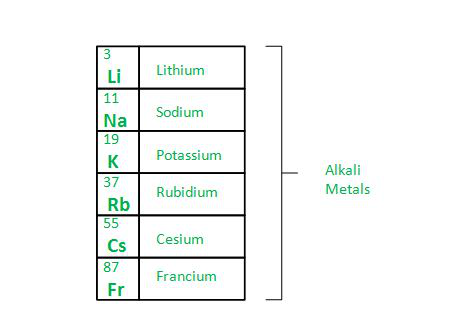
第 1 组元素
碱金属的特性
- 原子半径:随着原子序数的增加,碱金属的原子半径随着原子序数的增加而增加,因此随着原子序数的增加,新的能量壳层会增加。由于添加了能量壳,原子的大小从铍到镭的过程中增加了。
Be< Mg< Ca< Sr< Ba< Ra
- 沸点:碱金属的沸点比碱土金属的沸点低很多,并且随着族群的降低而降低,它遵循与原子尺寸相反的趋势,因为来自较小原子的电子比较大原子中的电子更难被热能激发.
Be> Mg> Ca> Sr> Ba> Ra
- 电子构型:碱金属的电子构型可以用惰性气体表示,一个价电子位于 s 轨道上。所以表示就像 [Noble Gas] ns 1 。
- 标准电位:碱土金属的标准电位遵循与原子大小相同的趋势,即离子的负标准电位随着原子大小的增加而向下增加。
Be> Mg> Ca> Sr> Ba> Ra
碱金属的物理性质
- 碱金属很容易被热能电离。
- 这些金属显示出光泽的特性。
- 它们可以被打成薄片,因为这些元素具有延展性。
- 碱金属的热导率相当高。
- 这些元素很容易切割,因为它们本质上是柔软的。
- 碱金属由于密度低而漂浮在水面上。
- 这些元素倾向于显示放热反应。
碱金属的化学性质
- 碱金属与水反应形成氢氧化物并释放出H 2气体。
2X + 2H 2 O → 2X + + 2OH – + H 2
其中 X 是碱金属
- 它们还与空气反应形成不同的金属氧化物。
- 这些元素与由氟、氯、溴和碘组成的卤素基团反应形成相应的卤化物。
2M + X 2 → 2MX
其中 X 是卤素,M 是碱金属
- 在高温下,碱金属可以与氢反应形成相应的氢化物。
2X + H 2 → 2X + H –
其中 X 是碱金属
- 这些元素与空气和水发生反应,因此为避免发生任何反应,这些元素被保存在煤油中。
- 碱金属的性质是还原性的。
碱金属的用途
- 锂也被心脏起搏器用于医疗领域。
- 锂主要用于可充电和不可充电的电池。
- 铯在热电发电中用作硫化铯。
- 钾在肥皂、清洁剂、清洁剂和金矿中也有许多用途。
- 钠用于许多金属的提纯过程。
Two or more elements join to form compounds so alkali metals form ionic compounds as alkali metals are of group 1 and have an oxidation state of +1.
碱金属化合物的特性
氧化物
碱金属在与氧气反应时也会形成相应的氧化物和一些过氧化物。这些氧化物在纯净形式下是无色的。这些氧化物的结构是岩盐型的。这些氧化物可溶于水。
X + O 2 → X 2 O
其中 X 是碱金属
氢氧化物
碱金属氧化物与水反应形成氢氧化物。这些氢氧化物本质上是碱性的,并且它们也是热稳定的。这些氢氧化物可以溶解在水中。
X 2 O + H 2 O → 2X + + 2(OH) –
其中 X 是碱金属
除氢氧化物外,还可形成过氧化物。
2XO 2 + 2H 2 O → 2X + + 2OH – + H 2 O 2 + O 2
卤化物
碱金属化合物与由氟、氯、溴和碘组成的卤素基团反应形成相应的卤化物。这些卤化物具有高熔点且无色。
含氧酸盐
碱金属具有与含氧酸基团形成盐的能力,所以让我们了解什么是含氧酸。含氧酸可以定义为酸性质子与含氧基团一起连接到羟基上的酸。例子是硫酸和碳酸。以下是含氧酸的特性:
- 它们很容易被水水解。
- 它们对热或温度变化稳定。
- 它们本质上是正电的,以自上而下的方式增加。
- 除碳酸锂外,含氧酸的所有其他碳酸盐都对热稳定。
- 含氧酸基团连接到与羟基连接的同一原子上。
示例问题
问题1:解释碱金属与氧气的反应?
回答:
Alkali metals react violently with oxygen and forms oxides, peroxides and superoxides depending on the metal and its size. As superoxides are generally unstable because of small cation but with large cation it will be stable.
Lithium forms oxide: 4Li + O2 → 2Li2O
Sodium forms peroxide: 2Na + O2 → Na2O2
Potassium forms superoxide: K + O2 → KO2
问题二:为什么碳酸锂对热不稳定?
回答:
Lithium carbonate is not so stable to heat as the atomic size of lithium is very small due to which it polarises a large carbonate ion which results in the formation of Lithium oxide and carbon dioxide that’s why lithium carbonate is not stable to heat.
问题 3:如何测试碱金属?
回答:
Alkali metals can be tested by dissolving them in liquid ammonia as in liquid ammonia they give deep blue colour because of ammoniated electrons. These electrons make this solution conductive in nature. This solution is paramagnetic in nature.
问题4:光电电池为什么要用铯和钾?
回答:
Caesium and Potassium have a special ability to lose electrons by absorbing energy from sunlight when light rays fall on these elements and this results in a photoelectric effect due to which caesium and potassium are used as electrodes in photoelectric cells.
问题5:氧化钾中钾的氧化态是什么?
回答:
Potassium reacts with oxygen to give potassium oxide as:
K + O2 → KO2
Potassium oxide is superoxide and the oxygen ion is represented as O–2 and hence the oxidation state of +1, this compound is neutral in nature.