就电子转移而言的氧化还原反应
各种化学和生物反应,如燃烧不同类型的燃料(木材、煤油、煤、液化石油气、汽油、柴油)、动物消化食物、植物的光合作用、从氧化铝中提取铝、电池或电池发电,铁的生锈属于氧化还原反应的范畴。
什么是氧化还原反应?
氧化还原反应是一种化学反应,其中氧化和还原同时发生。它是还原和氧化两个词的组合。如下式所示,这里的钠 (Na) 被氧化,而氢 (H) 被还原。因此,它们的氧化和还原同时发生。它涉及两个物种之间的电子转移。该反应用于制药、生物、工业、冶金和农业领域。
例如:
2Na + H 2 → 2NaH

氧化还原
- 氧化:定义为向物质中添加氧/电负性元素或从物质中去除氢/电正性元素。
- 例如:
S (s) + O 2 (g) → SO 2 (g) [加氧]
Mg (s) + Cl 2 (g) → MgCl 2 (s) [添加电负性元素(Cl)]
- 还原:定义为从物质中去除氧/电负性元素或向物质中添加氢/电性元素。
- 例如:
CuO (s) + H 2 (g) → Cu (s) + H 2 O (l) [脱氧]
2FeCl 3 (aq) + H 2 (g) → 2FeCl 2 (aq) + 2HCl [去除电负性元素]
基于电子转移的氧化还原反应
失去电子和得到电子同时发生的化学反应称为氧化还原反应。
例如:
MnO 4 – (aq) + SO 3 2- (aq) → MnO 4 2- (aq) + SO 4 2- (aq) [Mn获得1个电子,S失去2个电子]
如上式所示,镁(Mg)得到一个电子,硫(S)失去两个电子。因此,氧化和还原同时发生。这解释了该方程式是氧化还原反应的一个例子。
- 氧化反应:化学反应中任何物质的电子损失称为氧化反应。通过失去电子,物质的正电荷增加或物质的负电荷减少。
例如, 2Na + Cl 2 → 2Na + Cl –
氧化态:0 0 +1 -1
如上式所示,钠(Na)的氧化态从0变为1,这意味着它失去了一个电子或钠(Na)的正电荷增加。
- 还原反应:化学反应中任何物质获得电子称为还原反应。通过获得电子,参与物质的正电荷减少,而参与物质的负电荷增加。
例如, 2Na + Cl 2 → 2Na + Cl –
氧化态:0 0 +1 -1
在这里,氯是还原反应的一个例子,因为它的氧化态从 0 变为 -1,这意味着它获得了一个电子。
氧化还原反应的应用
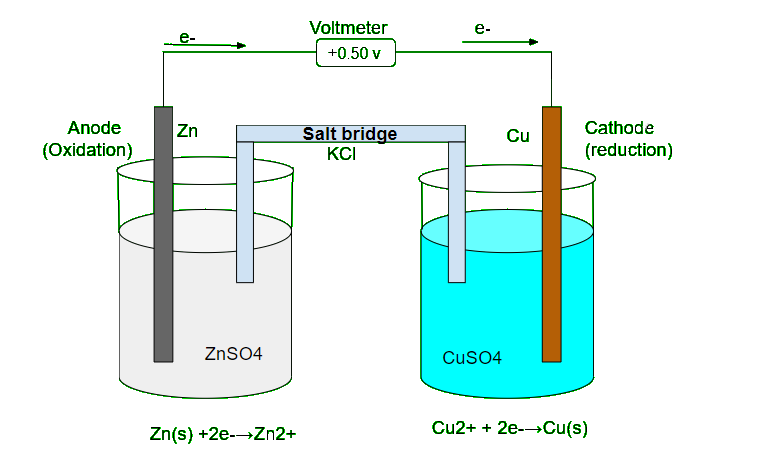
- 在原电池或伏打电池中,氧化还原反应用于将化学能转化为电能。
- 树木在光合作用过程中也使用氧化还原反应。
- 电镀是通过使用氧化还原反应完成的。
- 在氧化还原反应的帮助下制备肥料、苛性钠等。
示例问题
问题 1:确定给定方程式中经历氧化和还原的物种-
H 2 S(g) + Cl 2 → 2HCl(g) + S(s)。
回答:
As chlorine (Cl) is an electronegative element and it is added to Hydrogen(H) so, H2S is oxidized. Hydrogen is added to chlorine (Cl), hence It is reduced.
问题2:在反应MnO 2 + 4HCl → MnCl 2 + Cl 2 +2H 2 O 中,哪个物质被氧化了?
回答:
As addition of chlorine occurs in HCl. Hence, it is the oxidizing agent.
问题 3:为什么给定反应 - CH 4 (g)+2O 2 (g) → CO 2 (g)+2H 2 O 是氧化反应的一个例子?
回答:
As oxygen is being added in CH4 so, addition of oxygen signifies oxidation.
问题 4:命名最佳还原剂和最佳氧化剂。
回答:
Fluorine is the best oxidizing agent ,Lithium is the best reducing agent.
问题5:为什么F –离子不能通过化学方法转化为F 2 ?
回答:
As Fluorine is an oxidizing agent and it does not lose electrons. So, it is chemically impossible.
问题 6:指定 NaH 2 PO 4 中 P 的氧化数。
回答:
Let x be oxidation no. of P.
Oxidation no. of Na=+1
Oxidation no. of H = +1
Oxidation no. of O = -2
Therefore,
Na+1H2+1PxO4-2
1(+1)+2(+1)+1(x)+4(-2)=0
1+2+x-8=0
x=+5