第 15 组 p-block 元素 – 氮族
P 块元素的最后一个电子进入它所在壳层的三个 p 轨道之一。有六组 p 块元素,因为 p 亚壳具有三个简并 p 轨道,每个轨道可以容纳两个电子。
由于它们倾向于失去电子,P 嵌段元素是有光泽的并且通常是强电和热的导体。在像镓这样的 P 块元素中,您可能会发现元素的一些惊人特性。它是一种金属,会在你的手掌中融化。因为硅是玻璃的关键成分,它也是 p 区组中最重要的准金属之一。
第 15 组元素
从第 13 族到第 18 族,p 区元素位于元素周期表的右侧。氮族由五种元素组成:氮 (N)、磷 (P)、砷 (As)、锑 (Sb) 和铋 (Bi)。第 15 组的一般电子配置是 ns 2 np 3 。 Nitrogen 7 N Phosphorus 15 P Arsenic 33 As Antimony 51 Sb Bismuth 83 Bi
第 15 组元素的出现
- 氮气:百万分之七十八的空气。它是该组中最重要的成员,并以游离状态的双原子气体 N2 的形式出现。
- 动物和植物都需要磷才能函数运作。核酸,如 DNA 和 RNA,含有磷酸基团。磷酸盐约占骨骼和牙齿组成的 60%。
- 磷蛋白可以在蛋黄、牛奶和骨髓中找到。该组中的其他元素砷、锑和铋主要以硫化物的形式存在。一些例子是辉锑矿、毒砂和铋盐。
第 15 组元素的趋势
- 第 15 族元素原子半径 - 第 15 族原子的最外层有五个电子,s-subshel l 有两个电子,p-subshell 有三个电子。随着您向下移动该组,离子和原子半径随着每个顺序元素中的另一个主要能级的扩展而增长。
Element | Atomic Number | Electronic Configuration | Group Number | Period Number |
Nitrogen | 7 | 2s2 2p3 | 15 | 2 |
Phosphorus | 15 | 3s2 3p3 | 15 | 3 |
Arsenic | 33 | 3d10 4s2 4p3 | 15 | 4 |
Antimony | 51 | 4d10 5s2 5p3 | 15 | 5 |
Bismuth | 83 | 4f14 5d10 6s2 6p3 | 15 | 6 |
- 第 15组元素电离焓 - 第 15 组元素的初始电离焓大于第 14 组元素的可比成员。由于其更大的原子电荷、更低的核半径和稳定的半填充电子装置,它们更稳定。随着我们在组中的进展,电离焓值下降。这与原子尺寸的逐渐扩大有关。
- 第 15 组元素 电负性 - 电负性是指粒子将共享电子对拉近自身的能力。当一个人沿着基团前进时,由于原子半径的增加,电负性逐渐下降。
- 第 15 族元素金属字符-第 15 族元素的金属性较低。随着从 N 到 Bi 沿组向下进行,金属方面变得更加明显。 N、P等非金属元素为非金属,As、Sb等部分非金属元素为部分非金属,Bi等金属为金属。
- 第 15 族元素的熔点和沸点- 这组元素的熔点从氮上升到砷,然后下降到锑和铋。然而,随着从氮到铋的进展,沸点不断增加。

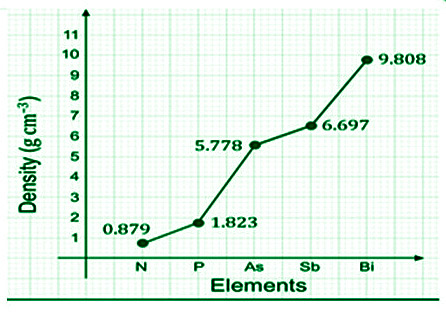
- 第 15 组元素密度点- 从 N 到 Bi,这些元素的密度同样上升。
- 第 15族元素同素异形体- 除铋外,所有第 15 族元素都表现出同素异形体。
- 氮有两种同素异形体:α氮和β氮。
- 磷以多种同素异形体的形式存在。红磷和白磷是两种最重要的同素异形结构。
- 砷的同素异形体结构为黑色、灰色和黄色。
- 黄色、金属和爆炸性是锑的三种重要同素异形结构。
- 第 15 组元素的氧化态——这组元素的最外层有五个电子,氧化态从 3 到 +5。这些元素的基本负氧化态为 3。随着沿基团向下移动,呈现 3 氧化态的可能性降低。由于原子尺寸和金属性质的增加,情况就是如此。通过创建共价键,第 15 族元素也可以具有 +3 和 +5 的正氧化态。由于惰性对效应,+5 氧化态的稳定性随着基团向下进展而降低,而 +3 氧化态的稳定性则升高。氮的价壳完全由 s 和 p 轨道组成,没有 d 轨道。因此,氮的最大共价为 4。它可以通过与另一个原子或离子共享其孤对电子来获得 4 的共价。磷与其余元素的共价键范围为五到六,也称为扩展共价键。由于价壳中存在未占据的 d 轨道,这是可行的。具有+5氧化态的第十五族元素的化合物都是共价的。在 +3 氧化态,生成离子和共价分子。
氮的异常行为
该组的主要元素的属性通常与其他组件的属性不同。氮的特征不同于该组中其他元素的特征。以下因素促成了氮的非凡特性:
- 因为它的核大小适中。
- 高电负性或电离焓。
- 没有d轨道。
- 发展各种关系的能力。
Property | Nitrogen | Phosphorus | Arsenic | Antimony | Bismuth |
Atomic Symbol | N | P | As | Sb | Bi |
Atomic Number | 7 | 15 | 33 | 51 | 83 |
Atomic mass (amu) | 14.01 | 30.97 | 74.92 | 121.76 | 209.98 |
Valence electron configuration | 2s2 2p3 | 3s2 3p3 | 3d10 4s2 4p3 | 4d10 5s2 5p3 | 4f14 5d10 6s2 6p3 |
Melting point Boiling point (oC) | -210 -196 | 44.15 281 | 817 603 | 631 1587 | 271 1564 |
Density (g/cm3) at 25o C | 1.15 | 1.8 | 5.7 | 6.68 | 9.79 |
Atomic Radius (pm) | 56 | 98 | 114 | 133 | 143 |
First Ionization Energy (KJ/mol) | 1402 | 1012 | 947 | 834 | 703 |
Common Oxidation state | -3 to +5 | +5,+3,+3 | +5,+3 | +5,+3 | +3 |
Ionic radius (pm) | 146 | 212 | 58 | 76 | 103 |
Electronegativity | 3.0 | 2.2 | 2.2 | 2.1 | 1.9 |
第 15 组元素的用途
- 氮和磷是生命存在所必需的两种元素。
- 氮气,N 2 ,构成了地球大气的大部分。像这样,pnictides 是双原子的 pnictogen 分子。由于它们的化合价,pnictide 原子形成共价三键。
- 磷存在于各种物品中,例如火柴、烟火和肥料。它也用于制造磷酸。
- 砷是一种有毒物质。它已被用作毒药和灭鼠剂。
- 合金是用锑制成的。
- 铋是一种化学物质,可以在药物、油漆和催化剂中找到。
示例问题
问题 1:第 15 族元素的物理性质是什么?
回答
- Polyatomic elements make up the whole group.
- The initial element, nitrogen, is a gas, but as the group progresses, the metallic aspect of the elements becomes increasingly apparent.
- Because of a drop in ionisation enthalpy and an increase in atomic size, bismuth is classified as a metal. Nonmetals include nitrogen and phosphorus, metalloids include arsenic and antimony, and bismuth is classified as a metal.
- Boiling points are often trending downward.
- Except for bismuth, all elements have allotropes.
问题2:第15族元素的原子半径是多少?
回答
The outermost shell of group 15 atoms has five electrons, the s-subshell has two electrons, and the p-subshell has three electrons. As you move down the group, the ionic and atomic radii grow as another primary energy level in each sequential element expands.
问题 3:为什么第 15 族元素称为 pnictogens?
回答
Pigeon means to choke or suffocate in Greek, hence Group 15 elements are called pnictogens. In the absence of oxygen, molecular nitrogen possesses this characteristic. As a result, group 15 elements are sometimes known as pnictogens or the nitrogen family.
问题 4:第 15 组的同素异形体是什么?
回答
The allotropes of group 15 are :
- There are two allotropic types of nitrogen: alpha nitrogen and beta nitrogen.
- Phosphorus occurs in a wide range of allotropic configurations. Red and white phosphorus are the two most significant allotropic structures.
- The allotropic structures of arsenic are black, grey, and yellow.
- Yellow, metallic, and explosive are three significant allotropic structures for antimony.
- Bismuth does not have any allotropes.
问题 5:第 15 族元素的用途是什么?
回答
- Two elements that are required for life to exist are nitrogen and phosphorus.
- The majority of the Earth’s atmosphere is made up of nitrogen gas, or N2. Pnictides are diatomic pnictogen molecules in the same way. Pnictide atoms form a covalent triple bond due to their valency.
- Phosphorus may be found in a variety of products, including matches, pyrotechnics, and fertilizer. It’s also utilised in the production of phosphoric acid.
- Arsenic is a poisonous metal. It’s been used as both a poison and a rodenticide.
- Antimony is used to make alloys.
- Bismuth is a chemical that is used in pharmaceuticals, paints, and as a catalyst.