期间和组中的电子配置
分子的电子构型是指电子在各种分子轨道上的分布。了解分子至关重要。分子或分子离子的键合和反键合分子轨道中的电子数可以从其电子构型计算出来。
An electronic configuration, also known as an electronic structure, is the arrangement of electrons at different energy levels around an atomic nucleus.
长电子配置通常由传统符号产生(特别是对于具有相对较大原子序数的元素)。在这种情况下,可以使用缩短或浓缩的符号来代替正常的符号。简而言之,与惰性气体的电子配置相对应的完全填充的子壳序列由方括号中的惰性气体符号代替。结果,钠的电子构型简写为[Ne] 3s 1 (氖的电子排布为1s 2 2s 2 2p 6 ,可简写为[He] 2s 2 2p 6 )。因此,电子配置可用于:
- 确定元素的化合价
- 预测一组元素的质量(具有相似电子配置的元素往往表现出相似的特性)。
- 原子光谱的解释。
电子配置周期
- 元素的周期是价壳的初级量子数 n 的值。
- 不同能级所能容纳的电子数是不同的。
- 2n 2 ,其中n是能级,是给定能级可以允许的最大电子数。因此,第一个能级(K 壳层)最多可容纳 2 个电子,第二个能级(L 壳层)最多可容纳 8 个电子,第三个能级(M 壳层)最多可容纳 18 个电子,以此类推。
- 第二个周期从锂和铍开始,它们分别有三个和四个电子,因此最终的电子达到了二级。
- 第三个周期以钠开始,以氩结束,依次填充 3s 和 3p 轨道。这一时期也有八种元素。
- 第 4 阶段首先填充 4 级,n = 4。这一切都从钾开始。但是,我们知道 3d 轨道必须是满的,4p 轨道才能被填满。钪是三维过渡元素中的第一个。 3d 轨道充满锌。
- 在第 5 个周期中,第 5 级首先被填充,n = 5。以钇开始的 4d 过渡系列在这次占主导地位。在周期结束时,5p 轨道完全被氙气填满。
- 当 n = 6 时,第六周期有 32 个元素,电子填充 6s、4f、5d 和 6p 轨道。铈表示电子进入 4f 轨道,产生镧系 4f 内过渡元素。
- 电子填充 7s、5f、6d 和 7p 轨道的人造放射性元素属于 n = 7 的第七周期。与周期 6 类似,该周期导致电子填充 5f 轨道,从而产生锕系5f-内部过渡元素。
分组电子配置
同一族元素的最外层具有相同数量的电子,从而产生相同的价层电构型。结果,同一族中元素的特征和化学性质遵循相似的模式。
原子轨道的填充
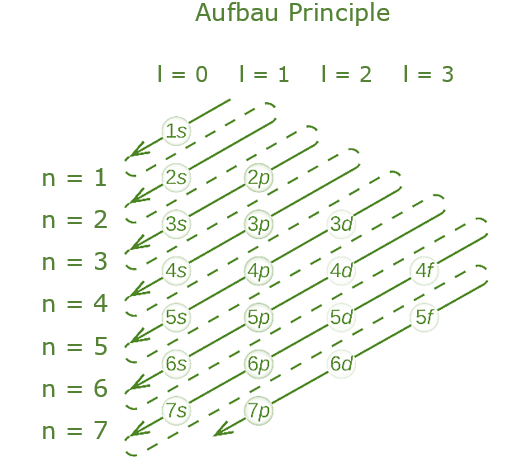
Aufbau原则
- 动词 Aufbeen 在德语中的意思是“建立”,是该原则名称的来源。
- 根据 Aufbau 原理,电子在移动到更高能量轨道之前将占据更低能量轨道。
- 轨道的能量是通过将其初级和方位角量子数相加来计算的。
- 根据这个原理,电子按以下顺序填充:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p .
- Aufbau 原则有一些例外,例如铬和铜。这些例外情况有时可以通过半填充或全填充子壳提供的稳定性来解释。
泡利不相容原理
- 根据泡利不相容原理,一个轨道最多只能容纳两个自旋相反的电子。
- 这个原理可以用另一种方式表述,即同一个原子中没有两个电子对于所有四个量子数具有相同的值。
- 因此,如果两个电子具有相同的原理、方位角和磁数,则它们必须具有相反的自旋。
亨德法则
- 该规则指定了电子在所有亚壳轨道中的填充顺序。
- 它断言,在将第二个电子放入其中之前,特定子壳中的每个轨道都仅被电子占据。
- 只有一个电子的轨道中的电子都具有相同的自旋以最大化总自旋(或自旋量子数的相同值)。
元素周期表前 20 个元素的电子配置: Element Symbol Atomic Number Electronic Configuration Hydrogen H 1 1s1 Helium He 2 1s2 Lithium Li 3 [He] 2s1 Beryllium Be 4 [He] 2s2 Boron B 5 [He] 2s2 2p1 Carbon C 6 [He] 2s2 2p2 Nitrogen N 7 [He] 2s2 2p3 Oxygen O 8 [He] 2s2 2p4 Fluorine F 9 [He] 2s2 2p5 Neon Ne 10 [He] 2s2 2p6 Sodium Na 11 [Ne] 3s1 Magnesium Mg 12 [Ne] 3s2 Aluminium Al 13 [Ne] 3s2 3p1 Silicon Si 14 [Ne] 3s2 3p2 Phosphorus P 15 [Ne] 3s2 3p3 Sulphur S 16 [Ne] 3s2 3p4 Chlorine Cl 17 [Ne] 3s2 3p5 Argon Ar 18 [Ne] 3s2 3p6 Potassium K 19 [Ar] 4s1 Calcium Ca 20 [Ar] 4s2
示例问题
问题1:元素的电子构型是什么?
回答:
An element’s electronic configuration is a symbolic representation of how its atoms’ electrons are arranged across different atomic orbitals.
问题2:编写元素的电子配置时要遵循的三个规则是什么?
回答:
- According to the Aufbau principle, electrons must completely fill the atomic orbitals of the previous energy level before occupying an orbital associated with a higher energy level. Electrons occupy orbitals in ascending order of increasing orbital energy level.
- No two electrons may have the same values for all four quantum numbers, according to Pauli’s exclusion principle. As a result, each orbital subshell can only hold a maximum of two electrons, both of which must have opposite spins.
- According to Hund’s maximum multiplicity rule, all subshells in an orbital must be occupied singly before any subshell can be occupied twice. In addition, all electrons in singly occupied subshells must have the same spin (in order to maximise the overall spin).
问题 3:为什么电子配置很重要?
回答:
Electron configurations provide insight into the chemical behaviour of elements by assisting in the determination of an atom’s valence electrons. It also aids in the separation of elements into distinct blocks (such as the s-block elements, the p-block elements, the d-block elements, and the f-block elements). This makes it simple to look into the properties of the components as a whole.
问题4:什么是泡利不相容原理?
回答:
An orbital can only hold a maximum of two electrons with opposite spins, according to the Pauli exclusion principle.
问题 5:洪德法则是什么?
回答:
Hund’s rule specifies the order in which electrons are filled in all of a subshell’s orbitals.