元件的电子配置
我们已经知道电子在原子中绕核运行,而质子和中子则包含在其中。问题是电子如何旋转?他们似乎在随意移动吗?他们有固定的路径吗?将它们放在一起的最佳方法是什么?电子配置是所有这些问题的答案。让我们看看电子是如何排列在原子核周围的。
不同轨道上的电子分布
原子的行星模型是由尼尔斯·玻尔创建的。他是第一个指出元素的属性具有规则模式的人。原子的电子结构基于“玻尔原子模型”。他是第一个描述电子在不同轨道/壳层(电子配置)中的排列的人。他提出电子分布在圆形(轨道)的电子壳中。这些电子在轨道上围绕原子核行进一段确定的距离。
在了解电子配置的概念之前,让我们先了解一些与之相关的基本术语,如下所述:
- 壳:它基于主量子数 (n),它决定了可以放置在壳中的最大电子数。每个壳层中的电子数由公式 2n 2给出,其中 n 表示壳层数。
- 子壳:它基于方位角量子数,广泛用“I”表示。同时,方位量子数取决于主量子数(n)的值。例如,如果 shell n=3 的值。与它对应的子壳将是 s、p 和 d,其中 I=0、I=1 和 I=2。这些是发生电子实际分布的壳。子壳层容纳的最大电子数由公式 2(2I+1) 给出。下面给出了可能的子壳及其基于量子数的电子配置。
| Value of principal quantum number | Azimuthal quantum number | Electronic configuration |
|---|---|---|
n=1 | I=0 | 1s |
n=2 | I=0 | 2s |
| I=1 | 2p |
n=3 | I=0 | 3s |
| I=1 | 3p |
| I=2 | 3d |
n=4 | I=0 | 4s |
| I=1 | 4p |
| I=2 | 4d |
| I=3 | 4f |
电子配置
The representation of electrons distributed in atomic shells of an element is known as electronic configuration. The electrons are mathematically located in these subshells and the notations help in locating the position of these electrons as well as the electronic configuration.
对使用特定符号编写的这些电子配置进行有效研究可以提供有关特定元素的详细信息。例如,锗 (Ge) 的具体符号为,1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 。
电子配置符号:
符号是子壳中存在的电子数量的表示。它用上标写有壳号、子壳的名称和子壳中存在的电子总数。
例如,氧的电子构型可以写为 1s 2 2s 2 2p 4 。
下表包含前 20 个元素的电子配置。 Atomic Number Name of ElementsElectronic Configuration 1 Hydrogen 1s1 2 Helium 1s2 3 Lithium 1s2 2s1 4 Beryllium 1s2 2s2 5 Boron 1s2 2s2 2p1 6 Carbon 1s2 2s2 2p2 7 Nitrogen 1s2 2s2 2p3 8 Oxygen 1s2 2s2 2p4 9 Fluorine 1s2 2s2 2p5 10 Neon 1s2 2s2 2p6 11 Sodium 1s2 2s2 2p6 3s1 12 Magnesium 1s2 2s2 2p6 3s2 13 Aluminum 1s2 2s2 2p6 3s2 3p1 14 Silicon 1s2 2s2 2p6 3s2 3p2 15 Phosphorus 1s2 2s2 2p6 3s2 3p3 16 Sulfur 1s2 2s2 2p6 3s2 3p4 17 Chlorine 1s2 2s2 2p6 3s2 3p5 18 Argon 1s2 2s2 2p6 3s2 3p6 19 Potassium 1s2 2s2 2p6 3s2 3p6 4s1 20 Calcium 1s2 2s2 2p6 3s2 3p6 4s1
填充贝壳的原则
以下是有助于填充原子壳的规则或原则:
- Aufbau 原理:该原理指出电子将占据能量较低的轨道,然后占据较高能级的轨道。该原则的名称来自希腊语“Aufbeen”,意思是建立。根据以下原理,电子按以下顺序排列,
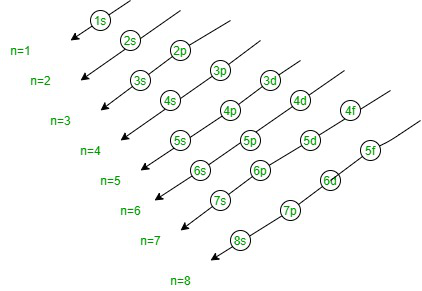
- 泡利不相容原理:泡利不相容原理指出,最多两个电子可以进入具有相反自旋的轨道。它基于这样一个概念,即如果两个电子的方位角数相等,那么它们在轨道上的自旋将相反。
- 洪德规则:该规则指出,在第二个电子填充轨道之前,每个轨道最初都被一个电子占据。这是决定子壳中电子顺序的规则。
如何写出元素的电子构型?
因此,在绘制电子配置之前,我们需要从元素周期表中提取一些信息,例如原子序数,不。电子,壳等。通过一个例子让我们了解电子配置的编写方法。钾元素的原子序数为 19。并且有 19 个电子将被放置在 s 和 p 子壳中。
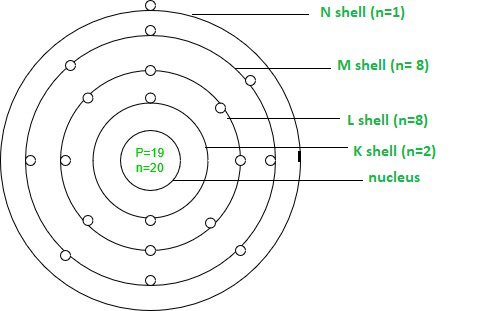
电子配置可以写成1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 。它的 19 个电子可以按以下方式划分为不同的壳层:
- K壳(n=1)= 2,
- L壳(n=2)=8,
- M壳(n=3)=8,并且
- N壳(n=4)=1。
钾的电子配置
示例问题
问题1:写出铝的电子构型。
回答:
The electronic configuration of Aluminum (Al) is 1s2 2s2 2p6 3s2 3p1 in spdf notation and 2, 8, 3 in orbital diagram.
问题2:列出电子配置的意义。
回答:
The significance are mentioned below:
- They help to know the reactivity state of the atom.
- It helps to determine its physical as well as chemical properties.
- It predicts an atom’s magnetic behavior, etc.
问题 3:写出理想气体的电子构型。
回答:
Following are the electronic configuration of some ideal gases:
- Helium (He) ⇒ 1s2
- Neon (Ne) ⇒ 1s2 2s2 2p6
- Argon (Ar) ⇒ 1s2 2s2 2p6 3s2 3p6
- Krypton (Kr) ⇒ 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
- Xenon (Xe) ⇒ 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6
- Radon (Rn) ⇒ 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6
问题 4:铜是如何违反 Aufbau 原则的?
回答:
Since, the electronic configuration of Copper is 1s2 2s2 2p6 3s2 3p6 3d10 4s1. The violation of the Aufbau principle is due to the energy gap between 3d and 4s orbitals. As the completely filled d-orbital offers more stability than the partially filled configuration.
问题 5:每个子壳层有多少个电子?
回答:
The electron filling pattern in subshells is:
- s holds 2 electrons
- p holds 6 electrons
- d holds 10 electrons
- f holds 14 electrons