碳的同素异形体
碳是生命所必需的非金属。拉丁语“carbo”意为“煤”,是该术语的来源。这是因为它是煤炭最重要的组成部分。从化石燃料到复杂分子,碳是大多数有机物质中最普遍的化学物质。地壳仅含有 0.02% 的矿物形式的碳,而二氧化碳仅占大气的 0.03%。尽管自然界中只有少量的碳,但碳的相关性似乎是巨大的:碳化合物存在于化石燃料、聚合物、肥皂、洗涤剂和我们使用的大多数药物中。
碳中的键合:碳的原子序数为6,这表明碳原子的电子构型为2,4。因为碳原子的最外层有四个电子,所以它共享这些电子并达到惰性气体状态。结果,碳原子与其他原子形成共价连接。
什么是同素异形体?
Allotropy is the occurrence of an element existing in two or more forms with distinct physical qualities but similar chemical properties, and the different forms are known as allotropes.
碳的同素异形体
同素异形体是碳中发生的一种现象,它以两种同素异形体形式出现:
- 结晶同素异形体形式的碳:碳有四种同素异形体,具有明确的晶体结构,
- 钻石
- 石墨
- 富勒烯
- 碳纳米管
- 无定形同素异形体形式的碳:碳的无定形同素异形体形式包括:
- 煤炭
- 可乐
- 木炭
- 动物炭
- 糖炭
- 油烟
- 气体碳
钻石
Diamond is a kind of carbon that has its atoms organised in a diamond cubic crystal structure. Another solid form of carbon known as graphite is the chemically stable form of carbon at normal temperature and pressure, although diamond nearly never transforms to it.
金刚石具有所有天然物质中最高的硬度和导热性,这些特性使其成为行业中切割和抛光设备的理想选择。
金刚石的结构
Jewel具有通过固体共价键结合的碳分子的三维组织。每个碳 iota 都处于 sp 3杂化状态并四面体连接到四个相邻的碳分子。这个组织延伸到三个测量。所有碳-碳 (C-C) 键均等价于 154 pm,每个 C-C-C 键点为 109 ∘ 28'。
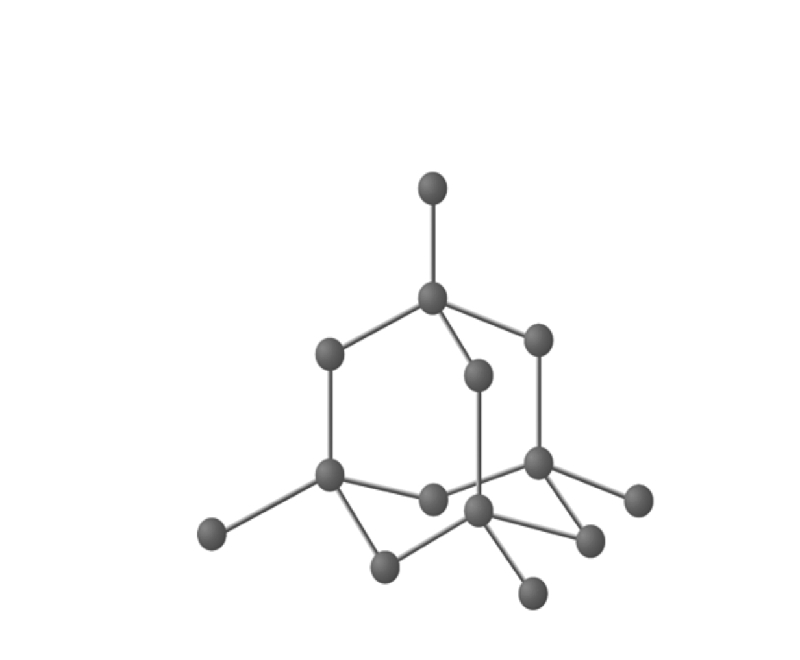
金刚石的结构。
钻石的特性
- 它是最完美和最密集的碳品种。其厚度为 3.51 gcm –3 。
- 它是已知最硬的常规物质,具有极高的软化点 (3843K),不溶于所有溶剂。
- 它很简单,可以测量高折射记录。
- 它是一种可怕的力量传送器。这是因为每个碳的所有价电子都与碳-碳西格玛 (σ) 键结合,宝石中不会留下未配对的电子。
- 综合而言,宝石几乎不受所有酸、抗酸剂和盐的影响。在任何情况下,它都会被熔化的碳酸钠跟进。当与重铬酸钾和硫酸的组合加热到 475 K 时,它会逐渐被氧化成二氧化碳。
- 宝石的价值取决于它的大小和阴影。淡蓝白色的珠宝比色调低的珠宝更有价值。深色宝石是最便宜的,不用于装饰品。
钻石的用途
- 钻石用于切割玻璃刀具、大理石锯和凿岩工具等。
- 由于其非凡的亮度,钻石被用于珠宝中。
- 眼科医生使用锋利的钻石以极高的精度去除眼睛上的白内障。
- 金刚石模具用于拉制非常细的金属线,例如钨。
石墨:一种非金属导体
Each Carbon atom in graphite is in a state of sp2 hybridization, which means it is covalently linked to three other carbon atoms in the same plane. Planar hexagonal rings are produced as a result. The length of the Carbon-Carbon bond in this ring is 142pm.
层由六角环形成。范德瓦尔的力量将这些层结合在一起,而下午 142 点将它们分开。因为这些层能够相互滑动,所以石墨柔软而光滑。
石墨的性质
- 它具有金属光泽,颜色为深灰色。
- 触摸它感觉非常柔软和油腻。
- 每个碳的第四个价电子可以自由移动,因为在石墨中形成六角环只需要每个碳的三个电子。因此,石墨是一种强热和电导体。
- 稀酸、碱和氯不会伤害它。使用重铬酸钾和硫酸的混合物将其缓慢氧化成二氧化碳。
石墨的用途
- 它用于制造碳弧和电极。
- 它是在高温下运行的设备的润滑剂。
- 铅笔是用这种材料制成的。石墨粉与粘土结合并形成棒状。铅笔是用这些棍子制成的。
- 它在原子反应堆中用作慢化剂。
- 它在钢铁生产中用作还原剂。
- 它是高强度复合材料的组成部分。
- 它被用来制造坩埚,可以抵抗极高的温度。
Buckminsterfullerenes:碳的合成同素异形体
Fullerenes are the main unadulterated type of Carbon since they don’t have astonishing edges or surface securities that draw in different iotas, as on account of graphite or jewel.
富勒烯是排列为C 2n的巨大圆形粒子,其中n≥30。富勒烯的所有意图和目的都是通过在惰性气体(例如氦气或氩气)中加热石墨,当脏材料被 C n小原子的堆积所包围时。
如此成型的肮脏材料主要由 C 60和少量的 C 70和少量不同的富勒烯组成。 C 60和C 70富勒烯可以通过用苯或甲苯萃取然后在氧化铝上色谱法从富勒烯残余物中迅速分离。
C 60富勒烯的结构
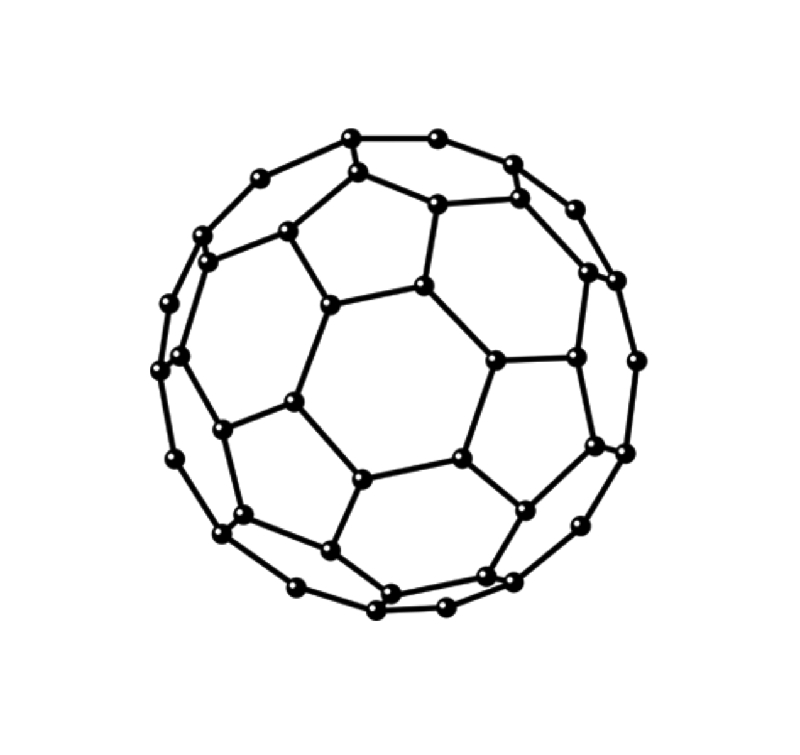
富勒烯的结构
为了纪念美国建筑师罗伯特·巴克敏斯特·富勒,C60 富勒烯有时被称为巴克敏斯特富勒烯或简称为富勒烯。富勒烯是一个 60 个顶点的碟形分子,每个顶点都有一个碳原子。它有 20 个环,六个成员和 12 个环,五个成员。
六元环可以稠合到其他六元环以及五元环,而五元环只能稠合到其他六元环。存在碳-碳长度分别为 142pm 和 138.3pm 的单键和双键。
富勒烯的性质
- 当温度变化时,富勒烯的行为和结构发生变化。富勒烯在更高的温度下转变为 C 70形式。
- 在不断变化的压力下,富勒烯的结构发生变化。
- 富勒烯的电离焓为 7.61 电子伏特。
- 富勒烯的电子亲和力为 2.6 至 2.8 电子伏特。
- 在化学过程中,富勒烯 (C 60 ) 模拟亲电体。
- 富勒烯具有充当电子受体的能力。它可以很容易地接收三个或更多电子。因此,它有可能充当氧化剂。
- 为了实现超导性,富勒烯掺杂有碱金属或碱土金属。
- 富勒烯具有铁磁性。
- 富勒烯富含碳化合物。因此,它极易溶于有机溶剂。
富勒烯的使用
- 使用由富勒烯制成的导体。
- 它具有吸收气体的能力。
- 使用由富勒烯制成的润滑剂。
- 富勒烯以多种形式用于制造化妆品相关产品。
- 石墨烯片构成碳纳米管。
- 富勒烯以某些方式用于生物应用。
示例问题
问题1:碳的最纯净形式是什么?
回答:
Because it lacks the glittering edges and surface bonds that attract other atoms seen in graphite and diamond, fullerene is the cleanest form of carbon.
问题2:富勒烯是如何获得的?
回答:
When graphite is heated in an electric arc in an inert atmosphere such as helium or argon, a sooty substance is produced by the condensation of Cn tiny molecules, resulting in fullerene. Extraction with benzene or toluene followed by chromatography over alumina separates the C60 and C70 fullerenes found in sooty material from the fullerenes soot.
问题3:石墨的用途是什么?
回答:
1) It’s used to make carbon arcs and electrodes.
2) It’s a lubricant for equipment that operate at high temperatures.
3) Lead pencils are made with this material. Graphite powder is combined with clay and formed into sticks. Pencils are made from these sticks.
4) It is employed in atomic reactors as a moderator.
5) It’s utilised in steel production as a reducing agent.
6) It’s a component of high-strength composites.
7) It’s utilised to make Crucibles, which can resist extremely high temperatures.
问题4:碳如何与其他原子形成键?
回答:
Carbon has an atomic number of 6, which indicates that the electronic configuration of the carbon atom is 2,4. Because a carbon atom’s outermost shell has four electrons, it shares those electrons and reaches the inert gas state. As a result, the carbon atom creates covalent connections with other atoms.
问题5:钻石的用途是什么?
回答:
- Diamonds are used to cut glass cutters, marble saws, and rock drilling tools, among other things.
- Because of their exceptional brightness, diamonds are utilised in jewellery.
- Sharp-edged diamonds are used by eye surgeons to remove cataracts from the eyes with remarkable precision.
- Diamond dies are used to draw very thin metal wires such as tungsten.