吸附等温线
任何分子物质在表面上的最高浓度聚集而不是固体(或液体)的聚集的现象称为吸附。它处理分离两个体相的范围内的化学。该范围也称为表面和界面。吸附的△H和△S为负值。大多数吸附过程是放热的,因此,吸附随温度升高而降低。
- 吸附剂是在其表面具有吸附作用的表面提取物。
- 吸附质是在表面集中或积聚的类型。
- 在吸附中,吸附剂的浓度仅在吸附剂表面增加,而在吸附中,浓度在整个固体中是均匀的。吸附是一种表面现象,而吸收是一种整体现象,例如水蒸气被无水氯化钙吸收,但被硅胶吸附。
- 当吸附和吸附过程同时发生时,使用术语吸附。
- 解吸是从吸附物质的表面去除吸附物质的过程。
影响气体对固体吸附的因素
- 吸附剂的性质 表面上的应变力越大,吸附发生在表面上的情况就越多。活化的吸附剂具有高吸附能力。
- 吸附剂的表面积 表面积越大,吸附越多。
- 被吸附气体的性质 NH 3 、HCl、Cl 2 、SO 2 、CO 2等易液化气体(临界温度高)被更大程度地吸附。
- 压力吸附随着压力的增加而增加。在低温下,压力的影响很大。
- 温度 由于吸附是放热过程,因此根据 Le-Chatelier 原理,吸附随温度升高而降低。
吸附等温线
The amount of adsorption of a gas per unit mass of the adsorbent depends on the pressure of the gas. The relationship between the amount of adsorbent at a constant temperature and the pressure (or concentration for a solution) of the equilibrium gas is called the adsorption isotherm.
它可以表示为方程或图形曲线(或绘图)。吸附量通常用 x/m 表示,其中 x 是吸附剂的质量,m 是吸附剂的质量。最简单的吸附类型是

从图中可以清楚地看出,吸附极限(x/m)随着压力的增加而增加,并达到与压力P对应的最大值,称为平衡压力。由于吸附是一个可逆过程,吸附也不会同时发生。在该压力(P)下,吸附气体的体积与脱水气体的体积相等,即使加压,吸附剂的量也保持一定。这种状态称为饱和状态,P称为饱和压力。科学家们试图用一些称为吸附等温线的经验数学关系来解释吸附。
Freundlich 吸附等温线
Freundlich 在 1909 年以数学方式给出了在特定温度下吸附程度 (x/m) 随压力 (P) 的变化。根据绘制的吸附等温线,可以很容易地得出以下观察结果:
- 低压时:该图几乎是一条直线,表明 m 与压力成正比。这可以表示为——
x/m ∝ P
要么
x/m = kP … (i)
其中 k 是一个常数。
- 在高压下:图表变得几乎恒定,这意味着它与压力无关。这可以表示为——

Freundlich 吸附等温线
x/m ∝ 常数
要么
x/m ∝ P ° (P ° = 1) … (ii)
x/m = kP °
- 因此,在压力的中间范围内, x/m 将取决于压力的功率,该功率在 0 到 1 之间,即范围为 0.1 到 0.5 的分数功率。这可以表示为压力(可能范围为 0.1 到 0.5)。这可以表示为:
x/m ∝ P 1/n
x/m = kP 1/n … (iii)
其中 n 可以取任何整数值,这取决于吸附物和吸附剂的性质。上述关系也称为 Freundlich 吸附等温线。
- 吸附等温线的 k 和 n 的计算:常数和 n 可以如下所述确定:
对等式两边取对数。 (iii),我们得到
log(x/m)= log k + (1/n) log P … (iv)
因此,如果我们在 y(纵坐标)上的 log (x/m) 和 x 轴(横坐标)上的 log P 之间绘制图表,将获得一条直线。这也说明了 Freundlich 等温线的有效性。直线的斜率等于 Un,截距等于 log k。
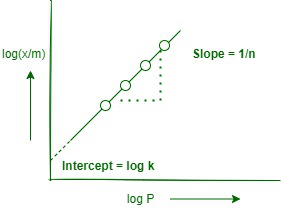
log(x/m) 和 log P 之间的线性图
Freundlich 吸附等温线的局限性: Freundlich 的吸附等温线在气体高压下失效。因此,这种关系被认为是近似的并且仅适用于低压。 Irving Langmuir 基于气体动力学理论的理论考虑推导出了一个简单的吸附等温线。这被称为朗缪尔吸附等温线。
示例问题
问题1.区分吸附和吸收这两个词的含义。各举一例。
回答:
Adsorption is a phenomenon in which the concentration of another substance is greater on the surface than in the bulk. Absorption is a phenomenon in which the molecules of one substance are evenly distributed throughout the body of another substance. For example, silica gel absorbs water vapor while anhydrous calcium chloride absorbs water.
问题 2. 说明为什么精细分散的材料经常被强调作为吸附剂。
回答:
Finely divided materials have more surface area and hence more adsorption.
问题 3. 为什么亲液溶胶比疏液溶胶静电大?
回答:
Lyophilic colloidal sols are much static because they are highly hydrated in solution
问题 4. 给出一个测试来区分给定的乳液是水包油型还是油包水型乳液。
回答:
It can be identified by dilution test. Thus, the emulsion is diluted with water. If the emulsion is diluted with water, it means that water serves as the dispersion medium and is an example of an oil in water emulsion. If, it is not dilute, the oil serves as the dispersion medium and this oil is an example of water in emulsion.
问题 5. 将氯化钠添加到氢氧化铁的胶体溶液中会出现什么情况?
回答:
When sodium chloride is added to ferric hydroxide sol, the sol. accumulates. This is because Cl– ions from NaCl neutralizes the positive charge on Fe(OH) sol.
问题 6. 溶胶和凝胶有什么区别?
回答:
In sol, the dispersion medium is liquid and the dispersion phase is solid. On the other hand, in a gel, the refraction to the solid and dispersed state is liquid.
问题 7. 当气体被吸附剂吸附时,△H 和△S 的符号是什么?
回答:
Adsorption is an exothermic process, so △H is always negative and △S is also negative because after adsorption of gas, entropy decreases.