金属反应性系列
周围的东西要么是金属的,要么是非金属的,我们需要区分它们,这里我们需要首先研究使金属和非金属不同的特性,并进一步研究它们的反应性。反应性系列是一个表格,提供有关不同金属反应性的数据,可用于预测一种金属是否可以在金属反应中取代另一种金属或金属对水和酸的反应性。反应性系列也有利于预测置换反应是单反应还是双反应。所有金属和非金属都有不同的性质,我们可以确定这种金属在空气、水或酸中是否更具反应性。在此,我们将了解金属的反应性系列和置换反应。
位移反应
置换反应是化学中重要的化学反应。它们被用于各种领域。例如,我们采用基于置换反应的电镀来防止铁制品生锈。
The displacement reaction is a kind of reaction in which a portion of one reactant is displaced by another reactant. It’s also known as a replacement reaction. As one ion of reactant is replaced by another ion of reactant. Thus, displacement reaction is defined as the elements which are more reactive metal displace less reactive element from its compound or solution.
硫酸铜 (CuSO 4 ) + 锌 (Zn) ⇢ 硫酸锌 (ZnSO 4 ) + 铜 (Cu)
在上述反应中,蓝色的硫酸铜转化为无色的硫酸锌。
置换顺序:位于其他金属上方的金属倾向于置换反应性系列中活性较低的金属(下方的金属)。当高活性金属(更容易形成正离子)从化合物或盐中置换出活性较低的金属时,就会发生置换反应。
位移反应的类型
有两种类型的置换反应,即:
单位移反应
单置换反应定义为一种(高反应性)元素从其化合物或盐中置换另一种元素的反应称为单置换反应。通常,它们显示为:-
X + YZ ⇢ XZ + Y
在一般反应中,X 比 Y 更具反应性。通常,金属及其盐会产生这种类型的反应。在这些反应中,反应性更强的金属可以从其盐中置换出反应性较低的金属。例如,钾 (K) 比镁 (Mg) 更具反应性,因此钾取代了氯化镁 (MgCl 2 ) 中的镁。这些反应如下:
2K + MgCl 2 ⇢ 2KCl + Mg
单次置换反应的一些例子如下:
- 锌 (Zn) 和硫酸铜 (CuSO 4 ) 之间的反应如下:
锌 + CuSO 4 ⇢ ZnSO 4 + 铜
- 铜(Cu)和硝酸银(AgNO 3 )之间的反应如下:
Cu + 2AgNO 3 ⇢ CuNO 3 + 2Ag
- 铅 (Pb) 和氯化铜 (CuCl 2 ) 之间的反应如下:
Pb + CuCl 2 ⇢ PbCl 2 + Cu
- 铁 (Fe) 和硫酸铜 (CuSO 4 ) 之间的反应如下:
Fe + CuSO 4 ⇢ FeSO 4 + Cu
双排量反应
双置换反应主要发生在水溶液中,其中离子沉淀和交换离子。双置换反应是反应物的阳离子和阴离子相互置换的反应。通常,它们显示为,
AB + XY ⇢ XB + AY
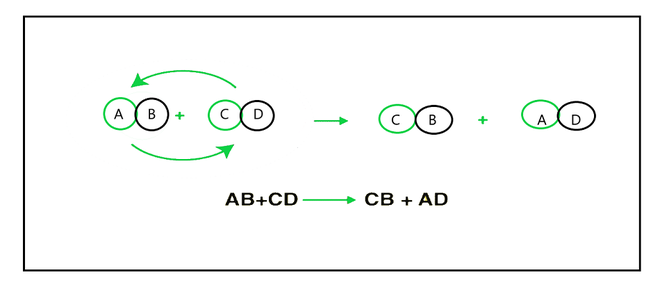
双位移反应
双置换反应的一些例子如下:
- 氯化钠 (NaCl) 与硝酸银 (AgNO 3 ) 的反应如下:
AgNO 3 + NaCl ⇢ AgCl + NaNO 3
- 硝酸钾 (KNO 3 ) 和氯化铝 (AlCl 3 ) 之间的反应,
KNO 3 + AlCl 3 ⇢ Al(NO 3 ) 3 + KCl
- 硝酸铅(Pb(NO 3 ) 2 )之间的反应 和碘化钾(KI),
Pb(NO 3 ) 2 + 2KI ⇢ 2KNO 3 + PbI 2
- 氯化铁 (FeCl 3 ) 和氢氧化钡 (Ba(OH) 2 ) 之间的反应,
FeCl 3 + Ba(OH) 2 ⇢ Fe(OH) 3 + BaCl 2
- 氯化钡 (BaCl 2 ) 和硫酸铜 (CuSO 4 ) 之间的反应,
BaCl 2 + CuSO 4 ⇢ BaSO 4 + CuCl 2
反应系列
反应性系列是一组基于其反应性的金属,从最高反应性到最低反应性。因此,金属反应性系列可以描述为以反应性递减顺序排列的一组金属。它有时被称为活动系列。金属的反应性是由它们不完整的外轨道或它们的电结构引起的。金属失去电子,导致形成带正电的离子。具有更高原子序数的金属更具反应性,因为它们的电子离带正电的原子核更远。结果,它们可以很容易地被移除。
反应性如下所示,其中表中的上层元素从其溶液或化合物中置换下层元素。 Symbol Element K Potassium (Highly reactive metal) Ba Barium Ca Calcium Na Sodium Mg Magnesium Al Aluminium Zn Zinc Fe Iron Ni Nickel Sn Tin Pb lead H Hydrogen Cu Copper Hg Mercury Ag Silver Au Gold Pt Platinum
从钾到钙的金属具有极强的反应性,甚至可以与水发生反应。从镁到铅的金属可以与酸反应。从铜到铂的金属具有极强的惰性,在正常条件下不会与任何其他材料发生反应。这就是为什么铂金和金不易腐蚀且不会产生氧化物的原因。而锌、铝、镁、钙等金属很容易产生氧化物。虽然氢是一种非金属,但它已被包括在反应性系列中,因为它有助于比较金属的反应性。
反应性系列的一些重要特征
- 排在最前面的金属的还原性很强,所以很容易被氧化。这些金属很容易失去光泽或腐蚀。
- 元素的电正性(失去电子的趋势)在降低金属的反应性系列时降低。
- 在向下遍历系列时,减少金属的趋势变得更弱。
- 在与稀 HCl 或稀 H 2 SO 4反应时,在活性系列中高于氢的所有金属都会释放出 H 2气体。
- 等级较高的金属需要更多的能量才能从矿石和其他化合物中分离出来。
反应系列的应用
反应性系列提供了金属的性质和反应性的研究,除了这些反应性系列还提供了其他几个重要的应用。例如,我们可以预测金属与酸、金属与水之间的反应以及金属之间的单一置换反应的结果。
- 金属与水的反应:钙和反应性系列中比钙更活泼的金属可以与冷水反应形成相应的氢氧化物,同时释放氢气。例如,钾和水之间的反应产生氢氧化钾和 H 2气体,如下面提供的化学方程式所述。
2K + 2H 2 O → 2KOH + H 2
与酸和碱的反应:金属从稀酸中置换出氢气,稀酸比氢气更具反应性,并形成相应的金属盐和氢气。
金属+稀酸→盐+氢气
金属钠倾向于从氯化氢 (HCl) 中置换出氢气,形成氯化钠并释放氢气。反应如下:
2Na(s) + 2HCl (稀释) → 2NaCl (aq) + H 2 (g)
示例问题
问题1:提及金属的物理性质。
回答:
Some of the physical properties of metals are:
- Good conductor of heat and electricity.
- Malleable
- Ductile
- Sonorous
- Lustrous
- Hard, high melting and boiling point.
问题2:食品包装用铝箔纸,为什么?
回答:
Due to property of its malleability it can be converted into thin sheets, than other metals it is cheaper and aluminium do not react with food items for long time, that’s why aluminium foils is used in wrapping foods.
问题 3:说出两种与空气和水发生剧烈反应的金属,它们存放在哪里?
回答:
Sodium and Potassium reacts vigorously with air and water. therefore they are kept in kereosene.
问题 4:哪种金属漂浮在水中,为什么?
回答:
Calcium floats in water because hydrogen gas formed on adding calcium to water, then water sticks to the surface of calcium and make it float in water.
问题 5:写出钠与水反应的反应。
回答:
Reaction of Sodium and water is explosive and it takes place as:
2Na (Sodium) + 2H2O (water) ⇢ 2Na(OH) (Sodium hydroxide) + H2⇡ (Hydrogen gas)