CX债券的命名和性质
化学分支涉及碳化合物的研究。例如甲烷、乙烷、尿素、DNA 等。并非所有碳化合物都是有机的。示例:氮、卤素、氰化物 (CN-)、二氧化碳、胺 (NH 3 ) 等。一些天然存在的有机化合物存在于植物和动物以及来自化石燃料和植物材料的合成有机化合物中。
用相同数量的卤素原子取代脂肪族或芳香族烃的一个或多个氢原子分别导致形成卤代烷(卤代烷)和芳基卤(卤代芳烃) 。在卤代烷烃中,卤原子与烷基的 sp 3杂化碳原子相连,而在卤代芳烃中,卤原子与 sp 2杂化碳原子相连芳基的碳原子。
卤素化合物的用途是,
- 含氯抗生素对伤寒的治疗非常有效。
- 合成有机卤素化合物广泛用于农业和工业。
- 用于治疗疟疾的氯喹(卤素化合物)。
- 在手术过程中,卤代甲烷被用作麻醉剂。
卤代烷(烷基卤化物)的命名
通常,烷烃的单卤衍生物称为卤代烷。卤代烷的全称由两个单独的单词组成。在 IUPAC 体系中,烷烃的单卤素衍生物的名称为卤代烷烃。它们的名称是通过在最长直链烷烃的名称前加上“晕”一词而得来的。烷烃的母体直链的编号是以具有卤素原子的碳原子获得最低可能编号的方式进行的。烷烃的任何单卤衍生物的 IUPAC 名称总是写成一个单词。
- 二卤素衍生物:它们分为三种不同的类型:
- 亚烷基二卤化物-二卤代烷烃是其中两个相同类型的卤素原子存在于相同的碳原子上,称为亚烷基二卤化物。同一碳原子上的位置称为孪位。例如二氯甲烷或二氯甲烷(CH 2 Cl 2 )、1,1-二溴乙烷或二氯甲烷(CH 3 CHBr 3 )等。
- 亚烷基二卤化物- 烷烃的二卤衍生物,其中两个相同类型的卤素原子存在于碳链的相邻碳原子上,称为亚烷基二卤化物。在 IUPAC 体系中,两个卤原子都以二卤代烷的名称为前缀。例如1,2-二氯乙烷或二氯乙烷(ClCH 2 CH 2 Cl)、1,2-二溴乙烷或二溴乙烷(BrCH 2 CH 2 Br)等。
- 聚亚甲基二卤化物- 在一个共同的系统中,烷烃的二卤衍生物,其中相同的两个卤原子存在于末端碳原子上,即碳链的α,ω-位置,称为聚亚甲基二卤化物。在 IUPAC 体系中,卤原子以二卤代烷的名称为前缀。例如,1,3-二溴丙烷或三亚甲基二溴(BrCH 2 CH 2 CH 2 Br)、1,4-二氯丁烷或四亚甲基二氯(ClCH 2 CH 2 CH 2 CH 2 Cl)等。
- 多卤代烷:在共同体系中,三卤甲烷和四卤甲烷分别称为卤仿和四卤化碳。例如,三氯甲烷或氯仿(CHCl 3 )、三溴甲烷或溴仿(CHBr 3 )等。
CX 债券的性质
卤代烷烃和卤代芳烃的 CX 键的性质不同,因此将两者分别讨论为:
卤代烷烃:卤素原子比碳更具电负性。因此,它们共享靠近卤素原子的一对电子。
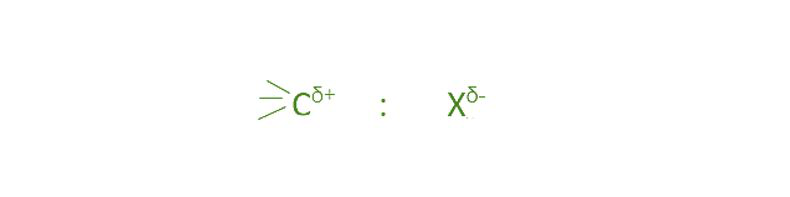
结果,卤素带有少量的负电荷,即δ-,而碳带有少量的正电荷,即δ+。随着我们沿着元素周期表往下走,卤素原子的大小会增加。氟原子最小,碘原子最大。所以碳卤键的长度也会增加 CF 到 CI。此外,当我们从 F 移动到 me 时,卤素的电负性降低,因此,CX 键的极性以及卤代烷的偶极矩也应该降低。
卤代芳烃:在卤代芳烃的情况下,与卤素相连的苯环的碳是 sp 2杂化的,它的长度很短,可以容纳更多的电子对,并且 CX 键本质上是极性的。因此孤对电子与苯环发生共振,这是由于孤对电子的这种离域导致双字符的形成。
卤代芳烃和卤代烷烃中CX键性质的显着特征
- 卤代烷烃的 CX 键比卤代芳烃的 CX 键极性更大。这是由于卤素比碳具有更高的电负性。
- 存在于苯环上的 X 原子上存在离域孤对电子,这导致卤代芳烃的 CX 键中的双键字符。
- 当我们在元素周期表中移动时,基团的原子大小会增加,因此卤代芳烃中的 CX 键长也会增加。
- 由于偶极矩取决于电负性差异,因此沿基团向下移动偶极矩也会减小。众所周知,Cl 的电负性低于 F,但 C-Cl 键的偶极矩大于 C-F,这是一个例外情况。
与CX 键的性质相关的参数
- 键长 -碳和卤素基团之间的键长会影响 CX 键的性质。随着我们向下移动组,卤素原子的大小继续增加。
F < Cl < Br < I
So, the difference in C-F is the least and largest in the C-I bond.
- 偶极矩——偶极矩的一般公式是μ = q × d,其中“d”是正负电荷之间的距离或电荷分离。即偶极矩是电荷和距离的乘积,是分子中化学键的计算极性。
So the order is:
CH3Cl > CH3F > CH3Br > CH3I
- 键焓 -如果我们谈论碳和氟原子的大小,那么它是相似的,并且存在形成非常强键的轨道重叠。但在 CI 的情况下,碘的大小比碳的大,可以形成弱键。因此需要大量的能量来破坏 CF 键,然后是 CI 键。
Here is the order of the bond enthalpy:
C-F > C-Cl > C-Br > C-I
重要卤代甲烷 (CH 3 -X) 的物理数据 Halomethane C-X bond length (pm) C-X bond enthalpy (KJ mol-1) Dipole moment (Debye) CH3F 139 452 1.847 CH3Cl 178 351 1.860 CH3Br 193 293 1.830 CH3I 214 234 1.636
示例问题
问题1:卤代芳烃不溶于水,但溶于苯,请解释。
回答:
Haloarenes are insoluble in water because they cannot form hydrogen with water molecules. how ever, these are soluble in benzene in accordance with the general principle of solubility i.e., like dissolves like. Haloarenes are organic compounds having a large hydrocarbon part and are solutions in hydrocarbon solvents like benzene.
问题2:二氯苯的对位异构体的熔点高于邻位和间位异构体。为什么?
回答:
The melting point of para isomer is quite higher than that of ortho or meta isomers. This is due to that it has a symmetrical structure and therefore, its molecules can easily pack closely in crystal lattices as a result intermolecular forces of attraction are stronger and therefore, greater energy is required to 88 its lattice and its melts at a higher temperature.
问题 3:碘仿在加热时会与硝酸银产生沉淀,而氯仿则不会。解释。
回答:
The Carbon-iodine bond is quite weak (213.4 KJ mol-1) as compared to the carbon-chlorine bond (326.4 KJ mol-1) Therefore, when the iodoform is heated with AgNO3 solution, C-l bond gets cleaved easily and iodide reacts with AgNO3 solution to give a precipitate of Agl. On the other hand, the C-Cl bond does not get dissolve.
问题4:工业中用作溶剂的有机卤素化合物是氯化物,而不是溴化物和碘化物。解释。
回答:
Organic alkyl chlorides are used in industry as solvents because chlorides are more volatile than bromides and iodides.
问题5:氯仿含有氯,但与AgNO 3溶液不反应。为什么?
回答:
CHCl2 contains chlorine but it is bonded to carbon by a covalent bond and therefore, it is not ionised. Hence, it does not combine with AgNO2 solution.
CHCl2 + AgNO2 ⇢ No reaction
问题6:为什么氯仿要存放在深色瓶中?
回答:
Chloroform is oxidised to poisonous phosgene in the presence of air as,
CHCl2 + 1/2O2 ⇢ COCl2 + HCl
Therefore, to protect it from light, chloroform is stored in dark coloured bottles.
问题7:氯仿瓶中通常会加入少量乙醇。为什么?
回答:
Alcohol retards the oxidation of chloroform to phosgene and it converts phosgene to ethyl carbonate.
2C2H5OH + COHCl2 ⇢ (C2H6)2CO3 + 2 HCl