铁生锈——解释、化学反应、预防
金属是一种在新生产、抛光或破碎时具有光泽外观的材料,并且可以很好地导电和导热。金属要么具有延展性,要么具有延展性(它们可以被锤打成薄片)(可以拉成金属丝)。金属可以是铁等化学元素,不锈钢等合金,或聚合氮化硫等分子化合物。
“金属”一词在天体物理学中的使用更为广泛,指的是恒星中所有比氦重的化学元素,而不仅仅是经典金属。从这个意义上说,通过核合成在恒星核心中积累的前四种“金属”是碳、氮、氧和氖,它们在化学上都是非金属。在其存在过程中,恒星将较轻的元素(主要是氢和氦)融合成较重的原子。在这种情况下,天文物体的金属丰度是指其质量中由较重的化学元素组成的比例。
铁锈
Rusting is the phenomenon of a reddish-brown coating forming on the surface of iron due to the action of wet air, and the reddish-brown coating is referred to as rust. Simply said, rust is a red-brown flaky substance that forms when an iron object is exposed to wet air for an extended period of time. Rusting is the term for this phenomenon.
钢铁生锈是金属腐蚀最普遍的例子。排气系统和车身、水管和多种结构钢结构的生锈都是众所周知的例子。空气和水对铁的共同作用使其生锈。在完全干燥的空气或完全没有水的空气中不会发生生锈。大气条件和调节生锈的成分的相对贡献决定了生锈的特定成分。它主要由水合氧化铁组成,所以锈的化学式是Fe 2 O 3 .xH 2 O。下面的反应可以大致表征它的形成:
4Fe + 3O 2 +2xH 2 O → 2Fe 2 O 3 .xH 2 O
铁的外表面在潮湿的空气中首先生锈,并在表面沉积一层水合氧化铁(锈)。这层细腻而多孔,如果太厚,可能会脱落。最低层的铁暴露在环境中,导致它们生锈。随着过程的继续,铁最终会失去力量。
What is the process of Rusting of Iron?
Iron rusting is an oxidation reaction. During rusting, iron combines with oxygen in the air in the presence of water to generate Fe2O3.xH2O, a hydrated iron (III) oxide.
This hydrated iron (Ill) oxide is referred to as rust. Rust is largely hydrated iron (III) oxide, Fe2O3.xH2O, as a result. The colour of rust is reddish-brown. We’ve all noticed reddish-brown rust on iron nails, screws, pipes, and railings. When exposed to wet air, not just iron, but also steel, rusts. Steel, on the other hand, is more resistant to rust than iron.
铁生锈是一种化学变化
当铁(或铁合金)在有水分的情况下暴露于氧气时会形成锈蚀。这个反应不是瞬间的;相反,它发生在很长一段时间内。当氧原子与铁原子结合时形成氧化铁。结果,物体/结构中的铁原子之间的键被削弱。
由于生锈反应,铁的氧化态增加,随后是电子的损失。锈主要由两种氧化铁原子的氧化态不同的氧化铁组成。这些是氧化物:
- 氧化铁 (II) 也称为氧化亚铁。该物质的氧化态为+2,化学式为FeO。
- 氧化铁 (III),通常称为氧化铁,是一种化合物,其中铁原子的氧化态为 +3。 Fe2O3 是这种物质的化学式。
铁是一种还原剂,但氧是一种极好的氧化剂。当暴露在氧气中时,铁原子很容易释放电子。化学反应描述如下:
Fe → Fe 2+ + 2e –
当水存在时,氧原子会增加铁的氧化态。
4Fe 2+ + O 2 → 4Fe 3+ + 2O 2-
铁阳离子和水分子现在经历以下酸碱反应。
Fe 2+ + 2H 2 O ⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
铁阳离子和氢氧根离子之间的直接反应也产生氢氧化铁。
O 2 + H 2 O + 4e - → 4OH -
Fe 2+ + 2OH – → Fe(OH) 2
Fe 3+ + 3OH – → Fe(OH) 3
产生的氢氧化铁现在被脱水,产生构成铁锈的氧化铁。该过程涉及许多化学过程,其中一些在下面给出。
- Fe(OH) 2 ⇌ FeO + H 2 O
- 4Fe(OH) 2 + O 2 + xH 2 O → 2Fe 2 O 3 .(x+4)H 2 O
- Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- FeO(OH) ⇌ Fe 2 O 3 + H 2 O\
上面列出的所有化学反应都有一个共同点:它们都需要水和氧气的存在。结果,可以限制金属周围的氧气和水的量以防止生锈。
铁生锈的必要条件是:
许多因素会导致铁生锈,包括空气中的水分含量和周围环境的 pH 值。以下是其中的一些元素。
- 水分:环境中水的可用性限制了铁的腐蚀。生锈最常见的原因是暴露在雨中。
- 如果金属周围环境的 pH 值较低,则会加速生锈过程。当铁暴露在酸雨中时,它会更快地生锈。较高的 pH 值会减缓铁腐蚀。
- 由于水中存在各种盐类,铁生锈的速度更快。盐水中的许多离子通过电化学过程加速生锈过程。
- 杂质:与含有多种金属的铁相比,纯铁生锈的速度更慢。
铁质物体的大小也会影响它生锈的速度。例如,一个巨大的铁物体,由于冶炼过程,很可能有轻微的缺陷。这些缺陷为金属的环境攻击提供了平台。
实验证明空气和水分对生锈至关重要:
证明生锈需要水分和空气的程序。
- 干净的铁钉应分别放在标有 A、B 和 C 的三个测试罐中。
- 用自来水填充试管 A 并塞住它。
- 用热蒸馏水填充试管 B,然后加入大约 1ml 油并塞住。油会浮在水面上,防止空气蒸发。
- 用无水氯化钙填充试管 C 并塞住。空气中的任何水分都会被无水氯化钙吸收。
- 在观察之前,让这些试管静置几天。
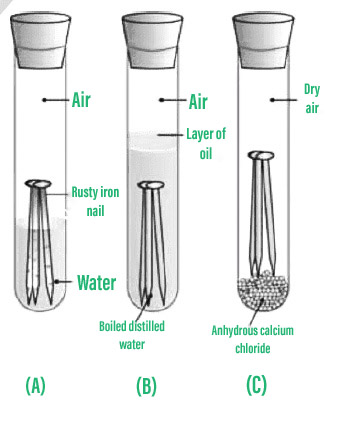
观察结果:试管A的铁钉生锈,试管B和C的铁钉没有生锈。试管 A 中的钉子由于暴露在空气和水中而腐蚀。试管 B 的指甲只暴露在水中,而试管 C 的指甲暴露在干燥的空气中。
结论:该实验表明,生锈需要空气(氧气)和水分发生。
What are the damages caused by Rusting of Iron objects?
Rust is permeable and soft, and as it slips off the surface of a rusty iron object, the iron beneath rusts. As a result, iron rust is a constant process that eats away at iron items over time, rendering them worthless. Rusting of iron causes significant damage over time since it is used to build a wide range of structures and commodities, including bridges, grills, railings, gates, and the bodies of cars, buses, trucks, and ships. It goes without saying that we should have a way to keep iron from rusting.
铁锈的预防
铁器因生锈而造成的损失对国家的经济影响巨大,必须避免。为了防止铁制品生锈,采用了多种技术。为了防止空气和水进入,大多数方法都需要在铁片上覆盖一些东西。以下是防止铁生锈的一些最普遍的方法:
- 油漆可以防止铁生锈:在铁的表面涂上油漆是最流行的防止生锈的方法。当油漆涂在铁质物体表面时,它可以防止空气和湿气与物体接触,防止生锈。为了防止生锈,窗花、栏杆、铁桥、钢制家具、铁路客车以及汽车、公共汽车和卡车的车身等都定期涂漆。
- 通过涂抹油脂或油可以防止铁生锈:当油脂或油涂抹在铁物体的表面上时,空气和水分不会接触到它,从而防止腐蚀。例如,钢铁工具和机器零件用油脂或油摩擦以防止腐蚀。
- 镀锌可以防止铁生锈:镀锌可以保护暴露在过度潮湿环境中的物品,例如屋顶板和管道,以防生锈。镀锌是在钢和铁上涂上一层薄薄的锌以防止生锈的技术。镀锌铁是经过镀锌处理的铁。锌比铁更具反应性,因此在存在水分的情况下,它会与氧气相互作用,生成一层看不见的氧化锌层,防止其进一步生锈。值得注意的是,即使镀锌铁制品上的锌层破损,它们仍然不生锈。因为锌比铁更活泼,所以情况就是这样。
- 电镀可以防止铁生锈:电镀是另一种防止物品生锈的方法。在此过程中,将包括锡、镍和铬在内的非腐蚀金属电镀在铁上。这种技术不仅可以防止商品生锈,还可以提高商品的美观度。浴室配件和车辆部件,例如自行车把手、汽车保险杠等,都是镀铬物品的例子。
- 铁的生锈可以通过将其合金化来制造不锈钢来防止:当铁与铬和镍合金化时,就会产生不锈钢。不锈钢是不生锈的。例如,不锈钢炊具、剪刀和医疗设备不会腐蚀。另一方面,不锈钢太贵而不能大量使用。
- 镀锡可防止铁生锈:锡无毒,反应性低于铁。食品罐是罐头的,这意味着它们上面有一层薄薄的锡。因此,当在钢铁物品上沉积一层电镀的锡金属薄涂层时,可以保护钢铁物品不生锈。使用镀锡餐盒是因为它们无毒且不会污染里面的食物。
- 上釉可以防止铁生锈:上釉是一种高温过程,涉及将玻璃粉熔化到金属基材中。搪瓷可用于各种表面,包括玻璃和陶瓷。
示例问题
问题一:铁生锈的过程是怎样的?
回答:
Iron rusting is an oxidation reaction. In the presence of water, the iron metal interacts with oxygen in the air to generate hydrated iron (III) oxide, Fe2O3.xH2O. This hydrated iron (III) oxide is referred to as rust. Rust is largely hydrated iron (III) oxide, Fe2O3.xH2O, as a result. Rust is a reddish-brown hue
问题2:铁生锈叫什么?
回答:
Rusting is the phenomena of a reddish-brown coating forming on the surface of iron due to the action of wet air, and the reddish-brown coating is referred to as rust.
问题3:如何防止铁生锈?
回答:
Rusting of iron can be prevented by
- Applying paint
- Applying grease or oil
- By galvanisation
- By electroplating
- Using alloying iron to make stainless steel
- By tinning
- Using Enameling
问题四:什么是锈?给出锈形成的方程式?
回答:
When iron is exposed to air for an extended period of time, it oxidises and develops a reddish-brown iron oxide on the surface. Rust is the name for this reddish-brown material.
Rust is formed via the following equation:
4Fe + 3O2 +2xH2O → 2Fe2O3.xH2O
问题5:生锈如何损坏铁器?
回答:
Rust is permeable and soft, and as it slips off the surface of a rusty iron object, the iron beneath rusts. As a result, iron rust is a constant process that eats away at iron items over time, rendering them worthless. Rusting of iron causes significant damage over time since it is used to build a wide range of structures and commodities, including bridges, grills, railings, gates, and the bodies of cars, buses, trucks, and ships. It goes without saying that we should have a way to keep iron from rusting.
问题六:生锈的必要条件是什么?
回答:
Many factors contribute to the rusting of iron, including the amount of moisture in the air and the pH of the surrounding environment. The following are a few of these elements.
- Moisture: The availability of water in the environment limits the corrosion of iron. The most prevalent cause of rusting is exposure to rain.
- The rusting process is accelerated if the pH of the environment around the metal is low. When iron is exposed to acid rain, it rusts more quickly. Iron corrosion is slowed by a higher pH.
- Due to the presence of various salts in the water, iron rusts more quickly. Many ions in saltwater speed up the rusting process through electrochemical processes.
- Impurity: When compared to iron having a variety of metals, pure iron rusts more slowly.
问题 7:铁锈怎么会是化学变化?
回答:
Rust is made up of iron oxide (Fe2O3). As a result, rust and iron are not synonymous. Rust isn’t the same thing as the iron it’s deposited on. Because a new component termed “iron oxide” is created during the rusting of iron, it represents a chemical change.