化学反应的类型
所有的化学反应可分为五类。知道如何识别未知反应的产物需要详细掌握这些类型的反应。结合、分解、单置换、双置换和燃烧是五种基本的化学过程。
什么是化学反应?
化学反应,即反应物分子内的键断裂的过程,为了形成新物质,在产物分子内形成新的键。让我们先弄清楚物理和化学变化。
- Physical change: When a usually reversible change in the physical properties of a substance, as size or shape takes place. Freezing a liquid, melting of candle, crushing a can, shredding papers all are examples of physical change.
- Chemical change: When a chemical property of matter changes it is a type of chemical change such properties are density change, change in temperature, energy change etc, It is commonly called a chemical reaction. Combustion, rusting, fermentation, etc. are examples of chemical change.
化学反应的性质
- 当两个或多个分子相互作用并形成新产物时,就会发生化学反应。
- 相互作用形成称为反应物的新化合物的化合物。和反应物相互作用后形成的化合物称为产物。
- 在化学反应中,化学变化必须发生在反应中的物理变化中,例如放热、颜色变化等。
- 反应可以在两个原子或离子或反应物分子之间发生,它们通过破坏旧键形成新键,没有原子被破坏或产生,而是形成了新产物。
- 反应速率取决于各种因素,如压力、温度、反应物浓度。
化学方程式
化学方程式是一种数学陈述,它显示反应物形成的产物,同时说明反应如何进行的某些条件。
A + B ⇢ X + Y
反应物在等式的左侧,而在等式右侧形成的产物通过单头或双头箭头连接。在化学中,反应物和产物是化学物质。以 Zn 与 HCl 的反应为例:

化学反应表示
- 放热反应:释放热能的化学反应称为放热反应。在空气中燃烧甲烷气体会产生热能。所有的燃烧反应本质上都是放热的。
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (l) + 热量
- 吸热反应:涉及能量吸收的化学反应称为吸热反应。示例:在氮和氧的反应过程中形成一氧化氮。
N 2 (g) + O 2 (g) + 热 → 2NO
化学反应的类型
根据生成的产物种类不同或反应物条件的变化,不同种类的化学反应有:
- 燃烧反应
- 中和反应
- 分解反应
- 氧化还原反应
- 双置换反应或沉淀
燃烧反应
燃烧反应是燃料和氧化剂之间的一种化学反应,产生一种称为氧化产物的产物。氧化剂是燃烧所需的化学燃料,例如氧气。通常,它是碳氢化合物和氧气之间的反应,产生二氧化碳、水和热量。
Hydrocarbon + Oxygen -> Carbon dioxide + Water + Heat
例子:
- CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g) + 加热
- 2Mg + O 2 → 2MgO + 热
中和反应
中和反应是酸和碱之间的反应,生成盐和水作为产物。水分子的形成是通过 OH- 离子和 H+ 离子的结合。当强碱和强酸发生中和反应时,产物的总 pH 值必须为 7。考虑盐酸 (HCl) 和氢氧化钠 (NaOH) 之间的中和反应产生氯化钠(食盐)和水。
- HCl (l) + NaOH (aq) -> NaCl (aq) + H2O (l)

中和反应
分解反应
在分解反应中,单个组分分解成两个或多个(多个)产物。需要一定量的能量来破坏反应物之间的键,例如热、电、光等。
分解反应的例子如下:
- 碳酸钙 (CaCo3) 分解产生 CaO(生石灰),这是水泥的主要成分。
CaCO 3 (s)热量> CaO(s) + CO 2 (g)
- 氢氧化钙(熟石灰)分解产生生石灰(CaO)。
钙(OH) 2 热量> CaO + H 2 O
- 盐 (NaCl) 的分解产生 Na 和 Cl 作为产物。
氯化钠 -> 钠 + 氯
氧化还原反应
一种还原-氧化反应,其中发生还原(获得电子)和氧化(失去电子),因此它是电子物种转移的过程。考虑一个锌和氢之间的电子化学细胞样氧化还原反应的例子。
Zn + 2H + → Zn 2+ + H 2

氧化还原反应
在上述反应中,一个锌原子与两个带正电的氢反应,电子从锌原子转移到氢上,氢变成一个稳定的分子,锌离子作为产物。
- 氧化 -氧化是电子的损失,给定反应物的氧化态增加。
- 还原 -还原是电子的增益,并且给定反应物的反应物状态降低。
单置换反应
在这种类型的反应中,反应性更强的金属从其盐中置换出反应性较低的金属。在这些反应中,通过反应系列,可以确定产物。反应性系列是一种元素按反应性递减顺序排列的系列。在这个系列中,位于系列顶部的元素比位于系列底部的元素更具反应性。
- 2K + MgCl2 -> 2KCl + Mg
钾与氯化镁 (MgCl 2 ) 的反应是单一置换反应的一个例子。在该反应中,钾从其盐中置换出镁,因为钾的反应性比镁高。钾存在于反应性系列的顶部,因此它是最具反应性的元素。
沉淀或双置换反应
这是一种置换反应,其中两种化学物质发生反应,因此它们的离子即阳离子和阴离子交换位置形成两种新产物。现在看看硝酸银和氯化钠之间的反应。双置换反应后反应产物为氯化银和硝酸钠。
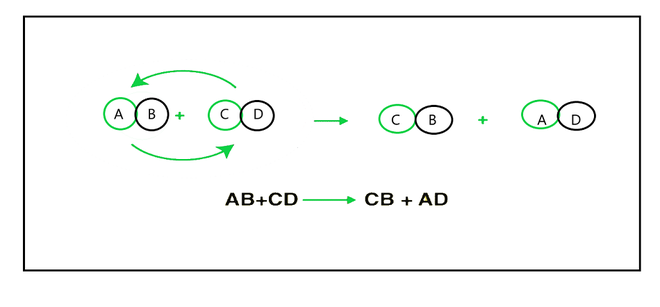
复分解反应
例子:
- AgNO 3 + NaCl → AgCl + NaNO 3
示例问题
问题 1:猜猜下面给出的反应类型:CH 4 + 2O 2 ⇢ CO 2 + 2H 2 O + 能量。
回答:
The above two reactions are combustion reaction.
问题 2:定义放热和吸热反应。
回答:
An exothermic reaction is a reaction in which there is an release of energy which can be in the form of light or heat. Few examples are nuclear fission, rusting of iron.
On the other hand, an endothermic reaction is the reaction in which the system absorbs heat from the surrounding in the form of heat. Few examples are melting of ice, cooking etc.
问题 3:定义术语反应物和产物。
回答:
Reactant- The molecules or chemical species that react to form a product is known as reactant.
Product- The resultant species that formed after the reaction is known as Product.
问题 4:在给定的反应中,确定被氧化和被还原的物质:MnO 2 + 4HCl → 2H 2 O + Cl 2
回答:
In the above equation HCl is oxidized to Cl2 and MnO2 is reduced to H2O, hence HCl is oxidized and MnO2 is reduced in the above reaction.
问题 5:求下列反应的氧化剂:H 2 S + I 2 > 2HI + S。
回答:
Addition of hydrogen is known as reduction whereas the reactant which get reduced is known as oxidizing agent. It is clear that I2 is reduced and hence it is an oxidizing agent.
问题六:为什么硫酸铜(CuSo 4 )溶液用铁钉蘸一下会变色?
回答:
When an iron nail is dipped in copper sulfate (CuSO4) solution, the displacement reaction takes place. The color of copper sulfate solution disappears due to the formation of light green solution of iron sulfate.
Fe(S) + CuSO4(aq) -> FeSO4(aq) + Cu(S)
问题7:哪些反应称为组合反应的反面?写出这些反应的方程式。
回答:
Decomposition reaction, is known as the opposite of combination reactions, In this reaction single compound breaks down to produce two or more simpler substances.
For example:
2H2O + electricity-> 2H2 + O2
While, combination reaction, is when two or more substances simply combine to form a new substance.
For example:
2H + O2 -> 2H2O