元素的原子序数
元素周期表是所有已知元素的组织,按原子序数和重复化学性质的顺序排列。它们以表格形式组织,一行代表一个时代,一列代表一个组。
元素周期表的历史
科学家假设元素质量是其原子质量的周期函数,因此门捷列夫将 63 个元素排列在称为组的垂直列和称为周期的水平行中。然而,这种分类技术无法解释某些元素、稀土金属和同位素的位置。结果,它被拒绝了。因此,在 1923 年,亨利·莫斯利引入了元素的一种新属性,称为“原子序数”。他认为元素的原子序数是比其原子质量更基本的特征。
杜宾犬的三合会
1829 年,德国化学家 JW Dobereiner 将三个元素的组命名为三元组。三元组的所有三种成分的物理和化学性质相似。 Dobereiner 的三元法是由他提出的。根据该定律,当原子按原子质量递增顺序分组时,中间元素的原子质量几乎等于其他两个元素的算术平均值,其性质介于其他两个元素之间。
纽兰兹八度定律
英国化学家约翰·亚历山大·纽兰兹(John Alexander Newlands)于 1864 年按原子量递增的顺序排列元素。(当时称为原子量)。他注意到每八个元素都与初始元素共享属性。它被纽兰兹称为八度音律。这是因为它类似于音符,其中每个八分音符都是第一个音符的重复。
门捷列夫的周期律和元素周期表
门捷列夫研究了当时已知的所有 63 种元素及其化合物的性质。当他将元素按原子质量递增的顺序排列时,他发现具有相似品质的元素会定期出现。他在 1869 年以下列陈述的形式做出了这一发现,这就是著名的门捷列夫周期律。元素的化学和物理特性是其原子质量的周期性函数。周期函数是在给定时间间隔后重复自身的函数。门捷列夫将元素组织成一张表,该表被称为门捷列夫元素周期表。
现代周期法
当代元素周期表是基于门捷列夫的元素周期规则和元素周期表。 18 世纪末,门捷列夫设计了他的元素周期表。那时,科学家们对原子的基本结构一无所知。量子理论的进步和许多原子模型的发展表明,原子序数是化学元素最基本的属性。这导致了门捷列夫的周期律的修订,现在被称为当代周期律。
Physical and chemical properties of elements are periodic functions of atomic numbers.
中性原子中的电子或质子数等于原子序数。在了解了元素的基本单位之后,科学家们现在对量子数和元素周期表中元素的电子配置有了透彻的了解。化学家们在了解了周期律后发现了 94 种天然存在的化学元素之间的相似之处。由于这种相似性,这些元素的化学性质引起了人们的兴趣。科学家们开发了许多人造组件。通过升级门捷列夫的元素周期表,构建了基于现代元素周期法的新元素周期表。
现代元素周期表
元素周期表的扩展版本是目前在世界范围内广泛使用的形式。在此版本的周期表中,水平行称为周期,而垂直列称为组。具有相似外壳电结构的原子的元素形成基团。以前,这些组被称为 IA、…VIII、VIII、IB…VIIB 和 0。但是,它们目前被称为 1、2、3、…18。当前元素周期表的七个水平行称为周期。量子数“n”决定了元素的周期。四个量子数之一是主量子数 (n)(n、l、m 和 s)。它告诉我们基本的电子壳层。
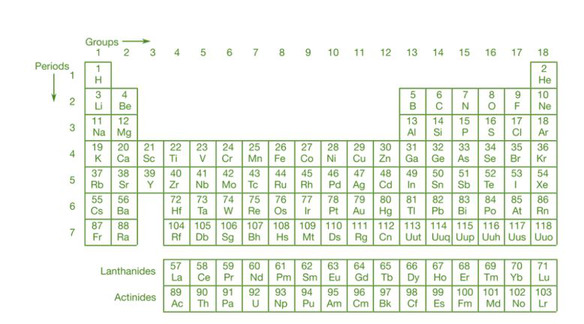
现代元素周期表
目前元素分类的依据:原子序数
当时,有 118 种已知元素被定期分类。根据属性将不同元素分类为不同类别的方法称为周期性分类。这些元素在元素周期表中被组织成组和周期。元素周期表中的元素按原子序数升序排列。该元素周期表由亨利莫斯利创建,基于元素的原子序数。周期与元素周期表的水平行相关,而组与垂直列相关。一个元素周期表中总共有 18 个族群和 7 个纪元。碱金属、碱土金属、镍元素、硫属元素、卤素和稀有气体均被 IUPAC 认可。其他组由其组号引用。
方法元素根据其特征进行分类是通过元素的周期性分类,其中我们持有一组中可比较的元素,而另一组中的其余元素。元素周期表中的几个空白区域已被保留以容纳未来的元素,这些元素将在不干扰元素趋势周期性的情况下被发现。
七个周期(也称为水平行)和十八组(有时称为垂直列)构成了目前的元素周期表。根据累积假设,元素根据它们的原子序数和电子填充其原子能亚能级的方式升序分类,每个元素的电子比它旁边的电子多一个。
当代元素周期表中元素的分类方式使得大多数元素都是金属。这些金属位于元素周期表的左侧。非金属是表中的一些元素;它们不到20个,它们存在于表格的右侧。准金属是存在于金属和非金属边界上的元素。它们的特性与金属和非金属相同。这些元素中的大多数是固体,只有 11 种是气体(稀有气体、氧气、氮气、氟、氯、氢),两种是液体(汞和溴)。
示例问题
问题一:现代周期律是谁制定的?
回答:
The periodic law was independently established in 1869 by Dmitri Mendeleev and Lothar Meyer. The first periodic table was established by Mendeleev, who was immediately followed by Meyer. Each classified the elements based on their mass and proposed that those attributes reoccur on a regular basis.
问题 2:周期趋势与周期律有何关系?
回答:
Periodic trends are recurring patterns in the periodic table that reveal information about an element’s electronegativity, atomic radius, and ionising power. When elements are grouped by atomic number, the periodic law asserts that certain qualities occur on a regular basis.
问题3:原子质量是周期性属性吗?
回答:
Nuclear mass generally decreases from left to right and always increases from top to bottom. Because the atomic number was formed as the foundation for ordering the elements on the periodic table, it will always rise from left to right and top to bottom.
问题4:哪个是相对周期性属性?
回答:
The valence shell electrical arrangement of any two elements at a particular period is not the same. As a result, elements have varying chemical properties throughout time, with a periodic gradation from left to right for their physical qualities. This is known called periodic property.
问题 5:为什么周期律很重要?
回答:
Periodic law is often regarded as one of the most significant principles in chemistry. Every chemist, whether consciously or unconsciously, employs Periodic Law while working with chemical elements, their properties, and chemical reactions. Periodic law drove the evolution of the present periodic table.