化学键的类型
各种状态,例如等离子体、玻色-爱因斯坦凝聚态、费米子凝聚态和夸克-胶子等离子体,无论固体、液体和气体的共同时间如何,都是可能的——例如,水以冰、液态水和蒸气蒸汽的形式存在- 但各种状态,例如等离子体、玻色-爱因斯坦凝聚态、费米子凝聚态和夸克-胶子等离子体,也是可能的。除此之外,它分为纯物质和混合物。
化学键
Chemical bonding is the process of uniting two or more atoms by the redistribution of electrons, resulting in each atom achieving a stable electronic state.
为了实现安全性,每个原子通过获得最近的可容忍气体电子排列来完成它们的双组或八位组。它通常通过在粒子之间形成复合连接来执行。
粒子可以通过三种方式形成化学键:
- 至少一个电子丢失给另一个原子。
- 从不同的原子获得至少一个电子。
- 通过将一个电子转移到另一个原子。
化学键的类型
化学键分为四组:
- Ionic键或电价键
- 共价键
- 氢键
- 极性共价键
Ionic键
八位组规则指出,当原子的价层有八个电子时,原子是最稳定的。固态原子在其价壳中失去、获得或共享电子以实现稳定性。当原子失去一个或多个价电子变成带正电的离子时形成阳离子,而当原子接收电子并变成带负电的离子时形成阴离子。
An electrical force of attraction known as the Ionic Bond emerges when electrons are completely transferred from the positively charged cation to the negatively charged anion.
当交换价电子时满足八位组规则,允许离子达到相邻惰性气体的电子配置。原子右侧的正上标电荷 (+) 表示阳离子。原子右侧的负上标电荷 (-) 表示阴离子。
例如:
- 当钠原子失去一个电子时,它会比失去一个电子多获得一个质子,从而使其整体带正(+1)电荷。钠离子的化学符号是 Na +1或简称为 Na + 。
- 当一个氯原子获得一个额外的电子时,它会形成氯离子 Cl - 。由于八位组规则,这些离子种类比原子更稳定。
Ionic键的形成
离子键或电价键是通过将一个或多个电子从正电或金属元素转移到负电或非金属元素而在两个原子之间产生的化学键。众所周知,钠原子的电排列为 2,8,1。在它的最外层,它只有一个电子。通过提供该电子 (2,8),它获得了 Neon 的惰性气体电气结构。
另一方面,氯原子的电排列为 2,8,7。它只需要一个电子来完成其八位字节并实现氩气(2,8,8)的惰性配置。
为了从其最外层去除一个电子并产生带正电的钠离子 Na + ,钠原子需要与其电离能大致相等的能量,约为 496kJ/mol。这被称为 endergonic 过程,因为它消耗能量。另一方面,缺少一个电子的氯原子吸收一个电子并释放与其电子亲和力相当的能量,即要产生一个氯离子,需要349kJ/mol。 Exorgenic 过程得名于在此过程中释放能量的事实。
结果,带相反电荷的离子产生静电吸引力,这是强大的吸引力。这些力使离子靠得更近,从而形成离子键。因此,静电力是离子连接的基础。
Electrovalency– The amount of atoms lost or acquired by one atom is referred to as electrovalency. In NaCl, the electrovalency of sodium and chlorine is one. As a result, they are monovalent. Calcium provides two valence electrons to generate calcium ions (2,8,8), and oxygen obtains two electrons to form oxide ions in the creation of Calcium oxide (CaO) (2,8). Calcium and oxygen have the same electrovalency, i.e. they are divalent. The oppositely charged ions are formed once the electrons are transferred. The development of an ionic link between sodium and fluorine atoms is seen here.
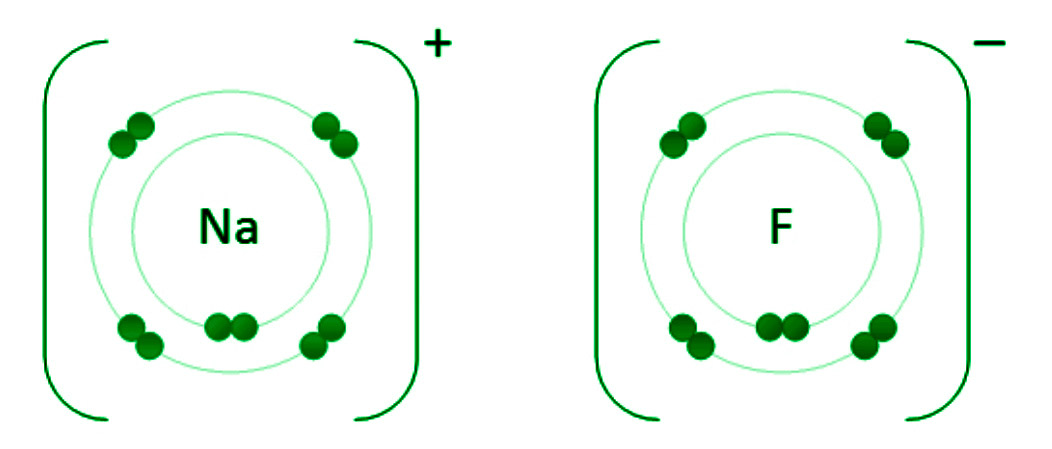
Ionic键形成条件
- 参与键合的原子中存在的价电子数-
在现代元素周期表的 I(A)、II(A) 或 13(A) 族中具有一个、两个或三个价电子的原子更喜欢失去电子并形成称为阳离子的带正电物质。另一方面,在当前元素周期表的第 15,16 和 17 族中具有 5,6 或 7 个价电子的原子更有可能吸收电子并形成称为阴离子的带负电物质。因此,钾在当前元素周期表的 I(A) 族中并在其最外层有一个电子,适合与氯建立离子连接,氯在第 17 族中并在其最外层有七个电子。因此,氯化钾被归类为离子物质。
- 金属的低电离能——
电离能是从中性气态原子的最外层去除电子所需的最小能量。考虑钠离子 (Na + ) 是如何由钠原子形成的。钠的电离能约为 500 kJ/mol,相对较低。它很容易脱落电子并变成钠离子。该离子还可能与其他阴离子如 Cl –和 Br –形成离子键。因此,当金属的电离能较低时,有利于离子键的产生。
- 非金属的电子亲和力——
将电子引入中性孤立气态原子时产生的能量定义为电子亲和力。考虑一个氟原子,它的最外层轨道包含七个电子。它毫不犹豫地接收一个电子以完成其八位字节结构。每摩尔,该反应释放大约 328kJ 的能量。所得氟离子的能量低于氟原子。我们都知道,减少的能量等于更多的稳定性。结果,氟离子比氟更稳定。因此,非较大金属的电子亲和力有利于阴离子的产生,从而形成稳定的离子结合。
- 离子化合物的晶格能——
离子化合物的晶格能是影响其稳定性的关键特征。当一克摩尔晶体由其气态离子产生时所产生的能量称为晶格能。静电吸引力将离子化合物的组成离子在任何晶体中保持在一起。
- 两个原子之间的电负性差异 -
原子在键形成过程中将电子拉向自身的能力通过其电负性来衡量。当原子的电负性值相差 1.7 或更多时,更有可能产生离子连接。考虑氯化钠 (NaCl) 和氯化氢 (HCl) 分子。
NaCl 的电负性差 =3.0(Cl)–0.9(Na)=2.1。
在氯化钠中,这有助于建立稳定的离子连接。
HCl 的电负性差 =3.0(Cl)–2.1(H)=0.9。
由于较小的电负性差异,氢和氯之间的联系是共价的。
Writing Formula of an Ionic Compound
The following two requirements must be met in order to derive the chemical formulae of ionic compounds:
- For optimum stability, the cation and anion should obey the octet rule.
- Ions should unite in such a way that their charges balance out and the ionic composition as a whole is neutral.
The number of electrons provided or received is represented by the charges on the anion and cation. In ionic bonding, the compound’s net charge must be zero.
Ionic键的性质
- 阳离子总是由金属形成,而阴离子总是由非金属形成。
- 在室温下,大多数离子化合物是结晶固体——离子化合物的组成离子相互之间具有很强的吸引力,并以三维结构组织。这种排列使水晶具有独特的几何形状。
- Ionic化合物具有高熔点,因为它们中的离子通过极强的吸引力保持在一起。Ionic化合物的熔点相对较高,这意味着打破它们之间的联系需要大量的热能。
- 电导率——Ionic化合物通常是固态的非导体。当加热超过它们的熔点时,离子之间的电力吸引力被破坏,离子可以自由移动。电流现在可以穿过这些自由离子。
- 当将氯化钠等离子化学物质引入水中时,水分子的负端会吸引阳离子并将它们从晶体中拉出。同样,水分子的正端会吸引阴离子,使化学物质溶解在水中。因此,Ionic化学品可溶于水等极性溶剂。
- Ionic化合物很脆弱,当对其晶体施加外力时,它们会破裂成碎片。这是因为氯化钠晶体中的 Na +和 Cl -离子在具有强静电吸引力的晶格中相互排列。
当施加外力时,离子的排列方式会发生变化,使相似的电荷靠得更近。由于高静电排斥,离子迁移分开。当离子粉碎成碎片时,晶体的形式会破裂。
共价键
- 简单来说,共价键是粒子之间的电子交换,以实现单个 iotas 的光荣气体配置。
- 好奇心的电强度将微量元素以共价键结合在一起。这种能量位于增强粒子的强带电核心和它们共享的带相反电荷的电子之间。
- 保持电子对是将iotas以共价键结合的电子。通过这些保持电子对,可以组织称为原子的不同粒子组 - 化合物的最小成分,具有该化合物的合成字符。
- 在偶数表中,这种类型的保持发生在相似成分的两个粒子之间或彼此接近的成分之间。这种保持主要发生在非金属之间,尽管也可以在非金属和金属之间观察到。
共价键的类型
根据共享电子对的数量,共价键可分为以下几类:
- 单共价键
- 双共价键
- 三重共价键
- 单一债券
当两个参与原子之间仅共享一对电子时,就会建立单键。一个破折号用于表示它 (-)。虽然它的密度较低并且比双键和三键弱,但这种共价键是最稳定的。
For Example, One Hydrogen atom has one valence electron and one Chlorine atom has seven valence electrons in the HCL molecule. By sharing one electron, a single bond is established between hydrogen and chlorine in this situation.
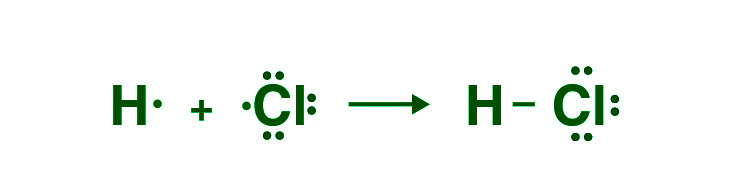
- 双键
当两个参与原子之间共享两对电子时,就会建立双键。两个破折号 (=) 用于表示它。双共价键比单共价键更强大,但它们也不太稳定。
Example: One carbon atom has six valence electrons and two oxygen atoms have four valence electrons in a carbon dioxide molecule.
Carbon shares two of its valence electrons with one oxygen atom and two with another oxygen atom to complete its octet. CO2 has two double bonds because each oxygen atom shares its two electrons with carbon.

- 三重债券
当两个参与的原子共享三对电子时,就建立了三键。最不稳定的共价键形式是三重共价键,用三个破折号 (≡) 表示。
For Example: Each nitrogen atom with five valence electrons contributes three electrons to form three electron pairs for partaking in the construction of a nitrogen molecule. The two nitrogen atoms create a triple bond as a result.

- 极性共价键:由于结合原子的电负性不同,当电子共享不均时,就会形成这种共价键。对于更多的电负性原子,电子的吸引力将更大。原子之间的负电差大于零但小于2.0。结果,该原子的共享电子对将更接近。
Example, An uneven electric potential causes molecules to form hydrogen bonds. The hydrogen atom interacts with the electronegative fluorine, hydrogen, or oxygen in this situation.
- 非极性共价键:当原子共享相同数量的电子时,就会产生这种共价键。两个原子之间的电负性差异为零。当连接的原子具有相当的电子亲和力(双原子元素)时,就会发生这种情况。
Example, Gas molecules such as hydrogen and nitrogen include nonpolar covalent bonds.
共价键的极化:在两个不同原子之间的σ键中,电子云总是更接近参与σ键的两个原子中电负性更大的原子。结果,该键形成一个永久偶极子,并且该共价键被称为极化。
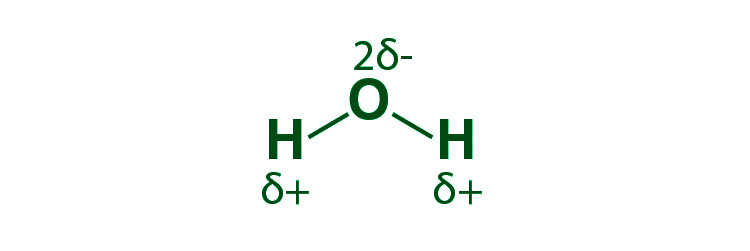
共价键的性质
- 由于适度的分子间吸引力,共价化合物具有低沸点和熔点。在环境温度下,这些化学物质以所有三种物理状态存在。虽然原子之间的共价相互作用相当强,但分子/化合物之间的分子间力或吸引力相对温和。当对共价键施加较少量的能量时,分子可以彼此分裂。因此,这些化学物质极易挥发。
- 熔化焓是在恒定压力下熔化一摩尔固体材料所需的能量。汽化焓是在恒定压力下汽化一摩尔液体所需的能量。改变分子共价化合物的相所需的热量仅是改变离子分子相的热量的 1 到 10 倍。
- 弱分子间吸引力是共价化合物的特征,导致它们采用气体、液体和软固体的形式。与许多特征一样,也有例外,特别是当分子化合物呈结晶形式时。
- 大多数可燃化合物由氢和碳原子组成。在氧气存在的情况下,这些化学物质很容易发生燃烧过程,产生二氧化碳和水。由于碳和氢具有相似的电负性,因此它们一起存在于许多分子化合物中。
- 在水溶液中,电的通过需要离子。当分子化学物质与水混合时,它们会溶解成分子而不是离子。因为没有自由的移动离子来导电,所以当溶解在水中时,它们通常不能很有效地导电。
- 极性溶剂,如水,可有效溶解极性共价化合物。糖和乙醇是易溶于水的分子分子的两个例子。另一方面,非极性共价化合物不易溶于水,例如水和油。这些分子不能被水水合。
- 弱分子间吸引力将有机溶剂中的共价键和有机分子结合在一起。共价化合物中的共价分子很容易与有机溶剂中的有机分子混溶,因为它们具有相同的弱分子间吸引力。因此,大多数共价化合物可溶于有机溶剂。
- Lewis的理论也考虑了键长;连接越强,共享的电子越多,键长越短。
共价键和Ionic键的区别
Parameters | Covalent Bond | Ionic Bond |
| What is it? | It is a kind of chemical bonding between two non-metallic atoms characterised by the sharing of electron pairs between atoms as well as other covalent connections. | It is a sort of connection generated by the strong electrostatic force of attraction between oppositely charged ions in a chemical molecule, also known as an electrovalent bond. |
| Occurs between | Two non-metals or a non-metal and a metalloid | One metal and one non-metal |
| Nature of component particles | It is made up of discrete electrically neutral molecules. | Cations and anions are oppositely charged particles that make up ionic compounds. |
| State at room temperature | Gases, liquids, or low melting solids | Crystalline solids |
| Polarity | Low | High |
| Solubility | In polar fluids, polar covalent molecules dissolve. HCl in water, for example. Only organic liquids are soluble in non-polar covalent compounds. | Ionic chemicals are only soluble in polar solvents like water because they are polar. Inorganic liquids are insoluble. |
| Formation | They are created when two non-metals with identical electronegativities come together. Neither atom has enough strength to pull electrons from the other. For stability, they share electrons from the outermost orbital with their neighbours. | They are created when a metal(+ion) and a non-metal interact (-ve ion). Metals are stronger than non-metals, and non-metals may easily get electrons from metals. These two ions are attracted to one another and create an ionic connection. |
| Conductivity | Ions do not dissociate from non-polar covalent molecules. As a result, don’t conduct electricity. In water, polar covalent compounds quickly dissociate and act as good electrical conductors. HCl in water, for example. | Non-polar covalent compounds do not break down into ions. As a result, you will not be able to conduct electricity. Polar covalent compounds break down readily in water and behave as good electrical conductors. For instance, HCl in water. |
| Melting Point | Low | High |
| Boiling Point | Low | High |
| Example | Methane, Hydrochloric acid | Sodium Chloride, Sulphuric acid |
示例问题
问题1:什么是化学键?
回答:
Chemical bonding is the process of redistributing electrons between two or more atoms so that each atom achieves a stable electronic state.
问题2:化学键有哪些类型?
回答:
Covalent, hydrogen bonds, van der Waals contacts, and ionic or electrovalent bonds are the four chemical bonds found in chemistry.
问题3:哪些化学键最强?
回答:
The covalent link is the most powerful chemical bond. Due to the mutual sharing of electrons, they developed between two atoms. Water is a classic example of a covalent bond because both hydrogen and oxygen atoms exchange electrons.
问题4:是什么导致钻石的熔点如此之高?
回答:
Diamond is a carbon allotrope. Each of the carbon atoms in a diamond is covalently bound to four other carbon atoms. As a result, a massive covalent structure is formed. As a result, diamond is very hard and has a very high melting point.
问题5:什么是极性共价键?
回答:
When electrons are shared unequally, this type of covalent bond forms because the electronegativity of the joining atoms vary. For more electronegative atoms, the pull for electrons will be stronger. The electronegative difference between the atoms is more than zero but less than 2.0. As a result, the shared pair of electrons of that atom will be closer together.