气体动力学理论
大约在 1661 年,博伊尔、牛顿和其他一些科学家急切地试图寻找气体背后的理论,他们的行为甚至给出了一个以博伊尔命名的理论。然而,几年后,大约 150 年后,气体的实际动力学理论被发现,并由麦克斯韦、玻尔兹曼和其他人完成。该理论基于这样一个事实,即气体具有非常快速移动的原子和分子,并且作用于固体和液体的分子间力不作用于气体。让我们深入了解气体的动力学理论。
气体动力学理论
引入气体动力学理论来解释分子相对于亚微观粒子的结构和组成。该理论讨论了由于亚微观粒子的不断运动和碰撞而导致的压力增加。它还讨论了气体的其他性质,如温度、压力、体积、粘度、扩散、导热性等。该理论建立了微观粒子与宏观性质之间的关系。气体分子总是在不断地运动,并不断地相互碰撞并与容器壁碰撞,在这种情况下,学习气体的动力学既困难又重要。
气体动力学理论的假设
为了发展气体的动力学理论,有几个假设被考虑在内。让我们先看看这些假设,然后深入研究理论,
- 每种气体都由微观粒子的分子组成。单一气体的所有分子都是相同和相同的,但与其他气体分子的性质不同。
- 与两个分子之间的分子距离(大约为 10 -9 m)相比,分子的大小(也称为分子大小)可以忽略不计。
- 气体分子的速度通常非常高,它可以位于 0 到无穷大之间的任何位置。
- 气体的分子形状是球形的,是刚性的,并且是弹性物质。
- 平均自由路径被称为所有自由路径的平均值。自由程定义为分子在两次连续碰撞之间所覆盖的距离。
- 每单位体积的碰撞次数在气体中始终保持不变并且是常数。
- 气体分子之间没有吸引力或排斥力。
- 由于分子的质量非常小并且它们以非常高的速度行进,因此引力也可以忽略不计。
动力学理论和气体压力
气体分子对容器壁的连续轰击导致气体压力增加。根据气体动力学理论,气体分子在该点施加的压力可以表示为,
P = 1/3ρc-2
Where c = mean square speed of a gas molecule.
ρ = Density of the gas.
Suppose the container has n number of molecules each of mass m, then the pressure can be represented as,
P = ![]()
Where V = Volume of the gas.
理想气体的气体定律
如果假定气体本质上是理想的,则以下气体定律适用于它们。定义这些定律是为了了解理想气体及其体积、压力等参数。让我们来看看这些定律,
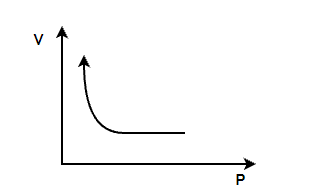
- 波义耳定律:根据波义耳定律,给定气体的体积与其在恒定温度下的压力成反比。
V ∝ 1/P
PV = Constant
For a given gas, P1V1 = P2V2
- 查尔斯定律:根据查尔斯定律,在恒定压力下,气体的体积与气体的绝对温度成正比。
V ∝ T
V/T = Constant
Therefore, V1/T1 = V2/T2
V1T2 = V2T1
- 压力定律(盖吕萨克定律):根据该定律,在恒定体积下,给定气体的压力与其绝对温度成正比。
P ∝ T
P/T = Constant
P1/T1 = P2/T2
P1T2 = P2T1
- 阿伏伽德罗定律:根据该定律,在 STP(标准温度和压力)下等体积的所有气体包含相同数量的分子,等于 6.023 × 10 23
- 格雷厄姆气体扩散定律:根据格雷厄姆气体扩散定律,气体的扩散速率与气体密度的平方根成反比。因此,气体的密度越大,其扩散速度就越慢。
r ∝ ![]()
- 道尔顿部分气体定律:根据该定律,由非相互作用气体混合物施加的净压力等于各个压力的总和。
P = P 1 + P 2 + P 3 +… P n
气体分子速度的算术平均值称为分子的平均速度或气体分子的平均速度。推导气体分子的平均速度有一个公式,
平均速度 = v平均= (v 1 + v 2 + v 3 +… v n )/n
Formula for mean speed, vmean = ![]()
同样,还有一个术语叫做气体分子的均方根速度,它被定义为气体分子速度的平方根。这个术语也有一个公式,
v有效值= ![]()
The formula for the root mean speed, vrms = ![]()
类似地,有一个术语称为气体分子的最可能速度,它定义为气体分子的最大数量所获得的速度,
Formula for most probable speed, vmp = ![]()
- 温度的动力学解释:分子中存在的总体平均能量与温度成正比。因此,平均动能是通过测量气体的平均温度而形成的。据此,当温度为 0 时,分子的平均能量为 0。因此,分子的运动在绝对值 0 处停止。分子的平均能量公式为:
U = 3/2 RT
非理想气体行为
在低压和高温下,假定所有气体都遵循理想的气体行为,从而遵循气体定律。对于真实气体,或在研究真实气体的过程中,大多指出与理想气体行为的偏差。它涉及谈论为理想气体定义的错误假设,而这些假设并未在实际气体行为中跟进。让我们来看看他们,
- 气体粒子是点电荷,没有体积。在这种情况下,粒子有可能被压缩到 0 体积,但这是真的吗?不,气体不能被压缩到 0 体积,实际上是不可行的,因此,它们确实有体积,不能忽略。
- 粒子之间不相互作用并且是独立的。这个假设是错误的,因为粒子确实根据性质相互作用。它还会影响一些术语,例如气体分子的压力。
- 粒子的碰撞本质上不是弹性的。同样,该陈述是错误的。粒子的碰撞在本质上确实是弹性的,并且它们在碰撞时确实会交换能量。因此,定义了能量的分布。
示例问题
问题 1:解释气体动力学理论的三个主要组成部分?
回答:
The three main components are,
- The molecules of the gas have linear motion
- No gain or loss in energy during a collision
- The particles do not have mass and occupy negligible space in a container.
问题 2:一种气体在 30 毫米汞柱的压力下占据 10 升。当压力增加到 50mmHg 时体积是多少?
解决方案:
Applying Boyle’s law,
P1V1 = P2V2
Now, P1 = 30mmHg, V1 = 10 liters, P2 = 50mmHg
30 × 10 = 50 × V2
V2 = 6 liters
问题 3:一种气体的体积为 300 cm 3 。在将其加热到 200° 摄氏度时,体积增加到 1500cm 3 。求气体的初始温度。
解决方案:
According to Charles’s law,
V1T2 = V2T1
V1 = 300cm3, T2 = 200° C, V2 = 1500cm3
300 × 200 = T1 × 1500
T1 = 40° C
问题 4:一种气体在 55 mmHg 的压力下占据 15.5 升。当压力增加到 75mmHg 时体积是多少?
解决方案:
Applying Boyle’s law,
P1V1 = P2V2
Now, P1 = 55mmHg, V1 = 15.5 liters, P2 = 75mmHg
55 × 15.5 = 75 × V2
V2 = 11.36 liters
问题 5:气体分子在 300K 温度和 2 bar 压力下的均方根速度为 2 × 10 4 cm/sec。如果温度升高两次,求出气体分子的新均方根速度?
解决方案:
The formula for the root mean speed, vrms = ![]()
Therefore, v ∝ √T
v1/v2 = √T1/ √T2
V1 = 2 × 104 cm/sec, T1 = 300K, T2 = 2 × 300 = 600K
(2 × 104)/v2 = √300/√600
v2 = 2√2 × 104 cm/sec