量化电子能级的证据
光速是由它所穿过的介质的性质决定的。结果,当光束从一种介质传播到另一种介质时,它会偏离或折射其初始路径。当一束白光透过棱镜时,可以看到波长较短的波比波长较长的波弯曲得更多。
因为典型的白光是由具有所有可见波长的波组成的,所以一束白光被分成一系列称为光谱的彩色波段。波长最长的红光偏差最小,而波长最短的紫光偏差最大。白光的可见光谱从 7.50×10 14 Hz 的紫色到 4×10 14 Hz 的红色。这被称为连续谱。因为紫色混合成蓝色,蓝色混合成绿色,等等。当彩虹在天空中形成时,它会产生类似的光谱。
请记住,可见光只是电磁辐射的一小部分。当电磁辐射与物质相互作用时,原子和分子可以吸收能量并转变为更高的能量状态。由于能量增加,它们处于不稳定状态。原子和分子在电磁光谱的各个部分释放辐射,以恢复其正常(更稳定、更低能量状态)的能量状态。
量化电子能级的证据
普朗克的贡献
在某些系统中,能量是量子化的,这意味着系统只能具有特定的能量,而不能像经典情况那样具有连续的能量。这类似于汽车只能以特定速度移动,因为它的动能只能具有某些值。我们还发现,某些类型的能量转移发生在离散的能量块中。虽然我们大多数人都知道物质可能被量化为称为原子、分子等的团块,但我们不太清楚能量也可以被量化。能量的量子化提供了量子力学优于传统物理学的一些最早迹象。
普朗克能够通过振荡器量化适当地表征科学已知的黑体光谱几何形状。这是能量可以在微小尺度上量子化的第一次证明,并为他赢得了 1918 年的诺贝尔物理学奖。尽管普朗克的理论是基于对宏观物体的观察,但它的分析是基于原子和分子的.普朗克本人不愿接受他自己的理论,即能级不是连续的,因为它与传统物理学有很大的不同。爱因斯坦对促进能量量子化的光电效应的解释大大提高了对普朗克能量量子化的普遍接受度。
发射和吸收光谱
当电磁辐射与物质的原子和分子相互作用时,这些原子中的电子可能会吸收能量并跃迁到更高的能量状态,从而导致它们失去稳定性。它们必须从较高的能量水平返回到先前的较低能量状态,以重新建立它们的稳定性。为此,这些原子和分子会在电磁波谱的不同部分释放辐射。
- 发射光谱是激发原子或分子中的电子释放的辐射范围。发射光谱定义为吸收能量的物质释放的辐射光谱。激发的原子、分子或离子是那些吸收了辐射的原子、分子或离子。为了产生发射光谱,通过加热或照射样品将能量施加到样品上,并测量样品释放吸收能量时释放的辐射的波长(或频率)。
- 吸收光谱类似于发射光谱的照相底片。辐射连续体通过吸收各种波长辐射的样品。令人眼花缭乱的连续光谱中的黑色间隔是由于缺少波长造成的,这对应于物质吸收的辐射。
- 光谱学是指研究发射或吸收光谱。如前所述,可见光谱是连续的,因为可见光的所有波长(红色到紫色)都在光谱中表示。另一方面,气相原子的发射光谱不显示从红色到紫色的连续波长范围,而是发射特定波长的光,它们之间有暗间隙。
- 因为光谱中亮线的出现识别了发射的辐射,所以这种光谱被称为线光谱或原子光谱。在电子结构的研究中,线发射光谱具有极其重要的意义。每个元素都有不同的线发射光谱。
- 与指纹识别人的方式相同,原子光谱中的特征线可用于化学分析来识别未知原子。已知元素原子发射光谱中的谱线与未知样品中谱线的完美匹配迅速证明了后者的身份。
- 德国化学家罗伯特·本生 (1811-1899) 是最早使用线谱鉴定元素的人之一。铷 (Rb)、铯 (Cs)、铊 (Tl)、铟 (In)、镓 (Ga) 和钪 (Sc) 等元素通过对其晶体的光谱分析进行鉴定。光谱方法被用来发现太阳中的元素氦(He)。
氢的线谱
我们都知道,原子或分子中的电子吸收能量并被激发,从较低的能级跃迁到较高的能级,当它们恢复到原来的状态时会发射辐射。这种现象也解释了通过氢的发射光谱,有时称为氢发射光谱。
在 1800 年代后期,人们发现当气体被放电激发并通过衍射光栅检查释放的光时,观察到的光谱由具有明确定义波长的离散线组成,而不是连续的光带。实验表明,这些线条的波长与发光的化学元素相匹配。它们是由原子的内在结构创造的原子指纹。
氢光谱是证明原子量子化电子结构的重要证据。当放电穿过气态氢分子时,氢原子解离。它导致发射电磁辐射,这是由高能激发的氢原子开始的。氢发射光谱由离散频率辐射组成。辐射系列以发现它们的科学家命名。
当在气态氢上进行放电时,H 2分子解离并且产生的高能激发的氢原子发射离散频率的电磁辐射。氢光谱由以发现者命名的多个系列谱线组成。 Balmer 在 1885 年根据实际发现证明,如果用波数来表示谱线,则氢光谱的可见谱线满足以下公式: 其中 n 为等于或大于 3 的整数(即 n = 3,4,5,... Balmer 系列是指由这个公式描述的线系列。氢光谱中唯一出现在电磁光谱可见区域的线是 Balmer 系列。
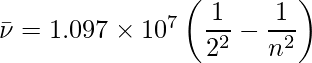
1.097 × 10 7被称为氢里德堡常数。对应于 n 1 = 1, 2, 3, 4, 5 的前五个系列分别称为 Lyman、Balmer、Paschen、Bracket 和 Pfund 系列。
氢原子具有任何元素中最简单的线谱。对于较重的原子,线谱变得越来越复杂。然而,所有线谱都有一些共同的特征,例如每个元素的线谱都是唯一的,每个元素的线谱都有规律性。
发射光谱和吸收光谱
- 吸收光谱类似于发射光谱的负值。
- 将电磁辐射轰击在吸收某些辐射波长的样品上以观察吸收光谱。
- 物质吸收的辐射波长会导致波长丢失,从而在原本令人眼花缭乱的连续光谱中留下黑暗的空隙。
- 每个元素都有不同的线发射光谱。光谱学是对发射光谱或吸收光谱的研究。
示例问题
问题一:什么是亚原子粒子?
回答:
Subatomic particles are the particles that make up an atom. This word often refers to protons, electrons, and neutrons.
问题2:同位素的原子结构如何变化?
回答:
They differ in terms of the total amount of neutrons contained in the atom’s nucleus, as described by their nucleon numbers.
问题3:玻尔的原子模型有什么缺点?
回答:
The structure of an atom, according to this atomic model, provides poor spectrum predictions for larger atoms. It also fails to account for the Zeeman effect. It could only successfully explain the hydrogen spectrum.
问题 4:如何确定同位素原子核中的中子总数?
回答:
The mass number of an isotope is calculated using the total number of protons and neutrons in the isotope. The atomic number describes the total number of protons in the nucleus. As a result, the number of neutrons is calculated by subtracting the atomic number from the mass number.