验证化学反应中的质量守恒定律
质量是一个孤立的系统。质量守恒定律指出,在化学反应中既不能产生也不能破坏质量。物质的原子只是为了形成化合物而重新排列。因此,整个系统的质量在任何时间间隔内都保持不变。这意味着反应物的总质量等于产物质量和未反应反应物质量的总和。质量守恒定律也称为质量守恒定律。
反应开始时整个封闭系统的质量等于反应结束时的质量。
Mass reactants = Mass products
验证质量守恒定律的实验
可以进行以下实验来验证质量守恒定律:
进行实验所需的东西:
- 氯化钡(BaCl 2 .2H 2 0),
- 硫酸钠(Na 2 SO 4 .10H2O),
- 两个分别为 100 和 150 毫升的烧杯。
- 身体平衡
- 两个手表眼镜
- 弹簧秤(0-500克),
- 聚乙烯袋
- 蒸馏水
- 一根玻璃棒。
该反应可视为沉淀反应,其中不溶性盐作为沉淀物分离出来。反应发生在氯化钡 (BaCl2 2 (aq)) 和硫酸钠 (Na 2 SO 4 (aq)) 之间。这两种化合物都以水溶液形式存在,即水作为溶剂。这是一种双重置换反应。
所涉及的反应是,
BaCl 2 (aq) + Na 2 SO 4 (aq) ————-> BaSO 4 (aq) + 2NaCl(aq)
无色无色白色沉淀
以标志性形式重新排列方程,我们得到,
Ba + (aq) + SO 4 2- (aq) ——————> BaSO4(s)
白色沉淀
参与反应的反应物是氯化钡和硫酸钠,而涉及的产物是硫酸钡和氯化钠。
现在,我们知道,
Mass of the reactants (barium chloride + sodium sulphate) = Mass of the products (barium sulphate + sodium chloride)
过程中涉及的步骤
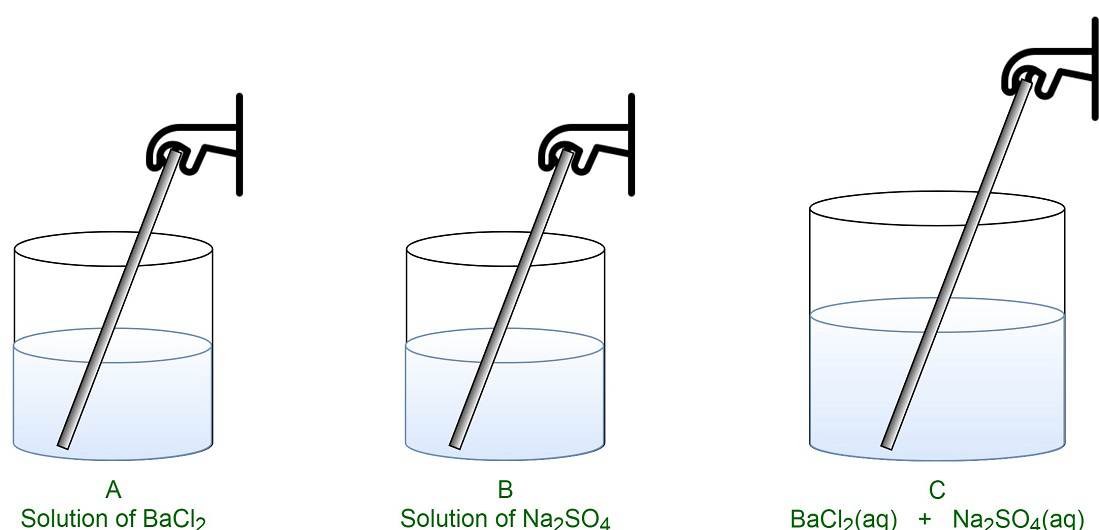
- 将 50 ml 蒸馏水放入两个 100 mL 烧杯中。
- 在物理天平上称量两个采取的手表眼镜。
- 将 3.6 g BaCl 2 .2H 2 0 放入表玻璃中。
- 将适量氯化钡水溶液溶解在 50ml 蒸馏水中。内容物储存在烧杯 A 中。
- 将 8.05 g Na 2 SO4.10H 2 O 放入另一个具有确定质量的表玻璃中。
- 将一定量的氯化钠水溶液溶解在 50ml 蒸馏水中。内容物储存在烧杯 B 中。
- 取一个 150 毫升的烧杯并使用弹簧秤进行测量。这个烧杯将包含最终内容并标记为 C。
- 通过使用玻璃棒不断搅拌,将烧杯 A 和 B 中的溶液混合在一起。
- 由于化合物硫酸钡(BaSO 4 )的形成,在烧杯C上出现沉淀物。
- 产品的总重量可以通过测量烧杯的重量来计算。
- 在反应之前和之后测量烧杯的内容质量。
实验期间的假设
在蒸馏水的情况下,假设密度为 1g /cc。
实验前需要注意的事项
- 应使用少量化学品进行反应。
- 最初,弹簧平衡指针应位于零标记处。
- 只有当指针处于静止位置时,才会读取弹簧秤的读数。
- 弹簧秤的读数应在垂直放置时进行。
- 应取所提到的质量的精确数量。
- BaCl 2和Na 2 SO 4的溶液应在不断搅拌下混合。
观察
从实验中可以得出以下推论,
氯化钡(BaCl 2 )水溶液的质量 = 3.6 g
BaCl 2溶液的质量 = 53.6 g
硫酸钠水溶液的质量(Na 2 SO 4 .10H 2 O)= 8.05 g
Na 2 SO 4溶液的质量=58.05 g
50 毫升蒸馏水的质量 = 50.0 克
计算反应物的总质量,我们有,
BaCl 2 + Na 2 SO 4 = 53.6 + 58.05
= 111.65 克
150 mL 空烧杯的质量,m1 =…………………….g
沉淀前反应混合物的质量,m2= m1+ 111.65 g = ……………………g
沉淀后反应混合物的最终质量,m3 =……………………。 G
结论
当我们将反应物的质量与产物的质量进行比较时,这两个质量被认为是相等的。这意味着观察到的质量 m 2 = m 3 。因此,质量守恒定律得以保留。
示例问题
问题 1. 守恒定律的适用性在哪里找到?
回答:
Law of conservation of mass can be seen in chemical reactions, like the production of carbon dioxide, or during the process of combustion of wood. It is applicable to all the phenomena occurring in the closed system.
问题 2. 什么是双置换沉淀反应?
回答:
Double precipitation reactions involve the switching of atoms from two different compounds. In these reactions, there occurs an exchange of ions resulting in the formation of two new compounds. The occurrence of this type of reaction is more evident in case the ionic compounds are dissolved in water as the solvent. The positive ions exchange negative ion partners. Any reaction of this form is,
AB + CD → AD + CB
问题 3. 还有哪些反应类型可以用来展示质量守恒定律?
回答:
Any combination reaction, where the reactants combine to form a product can be used to verify this law. For example, the production of water from hydrogen and oxygen molecules.
2H2 (4g) + O2 (32g) => 2H20 (36g)
问题 4. 给出一些其他的沉淀反应,可以很容易地用来验证这个定律。
回答:
NaCl(aq) + AgNO3(aq) => AgCl(s) + NaNO3(aq)
Rewriting as iconic eq. ,
Ag+ (aq.) + Cl– (aq.) => AgCl(s)
Here, AgCl separates out as a white precipitate.
问题 5. 哪些反应不符合质量守恒定律?
回答:
Nuclear reactions since some mass is destroyed in the form of energy.
E = mc2