热力学过程
热力学已经成为我们日常生活中不可或缺的元素。无论您是在车里、舒适地坐在有空调的房间里,还是从冰箱里啜饮冷饮,热力学几乎无处不在,无论是直接还是间接。
当热力学之父“萨迪·卡诺”介绍热力学定理和循环时,很少有人能预料到他的想法有一天会在汽车的发明中发挥如此关键的作用,汽车已成为我们生活中必不可少的一部分。热力循环由 Sterling Diesel、Otto 和 Ericson 进一步发展,导致更多的汽车发明和改进。在首先进入热力学过程之前,我们将看到一些与热力学相关的概念。
热力学
The branch of science that deals with the transfer of energy from one form to another, as well as the relationship between heat and temperature, energy, and work done, is known as thermodynamics.
换句话说,热力学是研究热和功对受热力学原理支配的物质状态变化的综合影响的科学分支。
热力学定律用于将与化学反应相关的热能转化为不同的可用形式。能源转换是基于这样一个事实,即能源只能从一种形式转换为另一种形式并用于许多行业。众所周知,化学反应具有与之相关的能量。热力学定律关注的是反应过程中发生的能量变化,而不是反应发生的速度。
Importance of Thermodynamics
- It aids in determining whether or not a chemical reaction can occur under a certain set of conditions.
- It aids in forecasting the severity of a reaction.
热力系统及周边
系统在热力学中被定义为正在研究和进行观测的宇宙区域。环境和宇宙相互作用,并且根据系统的类型,物质和能量被交换。系统的分类完全取决于进出系统的能量和物质的流动。有两种不同的系统:
- 开放系统-开放系统被定义为能量和物质交换的系统。当水在没有被覆盖的情况下在炉子上煮沸时,容器就像一个开放系统,因为它接收来自外部来源的热能并且排出的物质是水蒸气。
- 封闭系统- 封闭系统是一种只有能量而不是物质可以与环境交换的系统。封闭系统也可以被描述为具有恒定数量的物质,唯一的变量是系统的能量。例如,当我们在冰箱里放一瓶防护水时,尽管瓶中的水量保持不变,但环境中的能量损失会导致瓶内水的温度下降。
- 孤立系统-当一个系统被孤立时,它与环境之间不能交换能量或物质。保温瓶是隔离系统的一个例子。
热力学第一定律
The first law of thermodynamics is the universal law of energy conservation that applies to all systems. “The total heat energy change in every system is the sum of the internal energy change and the work done,” says this law. When a certain amount of heat, dQ, is applied to a system, a portion of it is used to increase internal energy, dU, and a portion is utilized to perform external work, dW, resulting in dQ = dU + dW.
气体的比热容由传递热容的过程或条件决定。对于气体,主要有两种类型的比热容。定容比热容和定压比热容是比热容的两种类型。
我们可以使用热力学第一定律确定理想气体的两个主要特定温度之间的关系。 Cp-C = R,根据关系。摩尔比温度 Cp 和 C 分别在恒压和恒体积条件下计算。
Cp > C 表示气体的定压比热容大于其定容比热容。这是因为当热量以恒定体积传递给气体时,气体不会对外部压力做功,所有的能量都用于提高气体的温度。当在恒定压力下对气体施加热量时,气体的体积会增加,并且热能用于提高气体的温度以及对外部压力做功。使气体抵抗外部压力膨胀所做的努力的热当量是两个比热之间的差。
热力学过程
让我们深入讨论以下热力学过程,如下所示:
1.准静态过程
The divergence of a system from its thermodynamic equilibrium in a quasistatic process is infinitesimally small. Equilibrium states are all the states that a system passes through throughout a quasi-static operation.
考虑一个系统,其中气体被封闭在带有移动活塞的气缸中;如果活塞以无限慢的速度被推动,系统将一直处于静止状态,该过程可以归类为准静态。
该过程的缓慢消失是准静态过程的一个关键特性。在准静态过程中,系统总是无限接近热力学平衡。准静态过程的概念是理想主义的,它的条件实际上永远无法精确满足。在实践中,足够慢且不需要加速活塞运动、大温度梯度或其他此类因素的过程是理想准静态过程的良好近似。除非另有说明,否则以下过程专门定义准静态过程。
2. 等温过程
The temperature of the system remains constant throughout an isothermal process.
波义耳定律指出,当 PV = 常数时,给定质量气体的压力与其体积成反比。在等温过程中温度没有变化,因为理想气体的内能仅取决于温度,因此内能没有变化。因此,U=0,Q=W 遵循热力学第一定律。因此,从系统中添加(或取出)的热量等于在等温过程中由系统完成(或在系统上)所做的功。下面是等温过程的 PV 图。
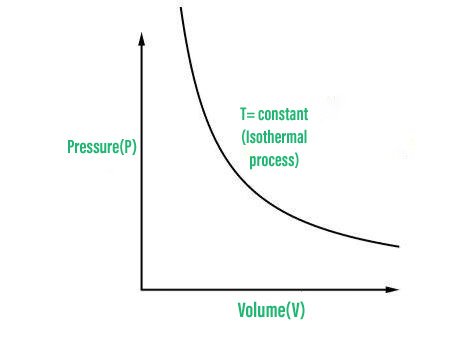
PV图
3. 绝热过程
An adiabatic process is one in which no heat enters or leaves a system. For every adiabatic process: ΔQ=0.
可以通过在系统上覆盖一层厚厚的隔热材料(如软木或石棉)来防止热流。热流需要一定的时间,所以如果一个过程快速完成,它基本上是绝热的。当我们将第一定律应用于绝热过程时,我们得到,
ΔU = U 2 -U 1 = - Δ W
这与绝热过程有关。绝热过程中系统内能的变化与系统所做的功成正比。当系统完成工作时,它会收缩,ΔW 变为负值。并且系统的内部能量增加了与在其上所做的功相同的量,并且系统的温度升高了。
如果系统执行任务,ΔW 为负。系统的内能减少,导致温度下降。在具有理想气体的绝热过程中,压力和体积之间的关系由下式给出,
PV = γ = 常数
其中γ=Cp/Cv。如果理想气体绝热状态从 (P 1 , V 1 ) 变为 (P 2 , V 2 ):
P 1 V 1 =P 2 V 2
绝热PV图是,
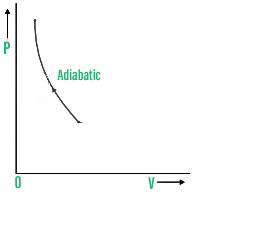
PV图
4. 等容过程
The volume of the system remains uncharged during an isochoric phase, i.e. ΔV = 0.
当体积不变时,不做功,ΔW = 0,因此违反了热力学第一定律。
U 2 -U 1 = ΔU = ΔQ
传递到系统的所有热量都用于提高系统的内部能量。在等容过程中连接 P、V 和 T 的方程产生 , P/T=常数,即随着温度升高,压力升高。等容过程的 PV 图。
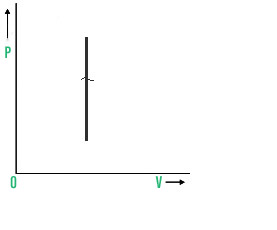
PV图
5. 等压过程
Isobaric process refers to a process that occurs at constant pressure.
从这个方程我们可以看出,等压过程中所做的工作是 W=P(V2-V1)= n R(T2-T1),其中压力保持在一个一致的水平。供应给系统的热量在升温和在此过程中做功之间分配,即
ΔQ = ΔU + ΔW
对于等压过程,连接 P、V 和 T 的方程是 V/T=常数,即随着温度升高,体积增加。等压过程的 PV 图可以绘制为,
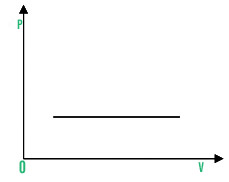
PV图
循环过程
系统在循环过程中返回到其初始状态。由于系统已经回到其起始状态,内能没有变化ΔU=0。在此过程中,吸收的总热量等于系统所做的总功,即
ΔQ = ΔW
循环过程的 PV 图可以绘制为,
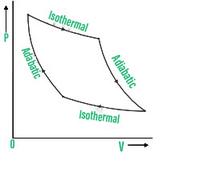
PV图
示例问题
问题 1:计算将 60 克铝的温度从 35 摄氏度提高到 55 摄氏度所需的千焦热量。铝的摩尔热容为 24 J mol -1 K -1 。
解决方案:
No. of moles of Al (m) = (60 g)/(27 g mol-1) = 2.22 mol
Molar heat capacity (C) = 24 J mol-1 K-1.
Rise in temperature (∆T) = 55 – 35 = 20 °C = 20 K
Heat evolved (q) = C x m x T = (24 J mol-1 K-1) x (2.22 mol) x (20 K)
= 1065.6 J
问题 2:对于孤立系统 ΔU = 0; ΔS 是多少?
解决方案:
An isolated system has no change in internal energy (∆U) since it does not exchange energy with its surroundings. In the event of a spontaneous reaction, however, entropy tends to grow. As a result, ∆S > 0 or positive.
问题 3:写出热力学的局限性。
回答
Limitations of Thermodynamics are;
- It aids in the prediction of a process’s feasibility but does not provide information on the rate of reaction.
- It merely discusses a system’s initial and final states, but it doesn’t go into detail regarding the process’ mechanism.
问题 4:定义第一运动定律?
解决方案:
Heat is a kind of energy, according to the First Law of Thermodynamics, and thermodynamic processes are therefore subject to the concept of energy conservation. Heat energy cannot be created or destroyed in this way. It can, however, be moved from one spot to another and changed into and out of different types of energy.
The first law of thermodynamics has the following equation:
ΔU = q + W
where,
- ΔU is the change in the system’s internal energy.
- q denotes the algebraic sum of heat transmission between the system and the environment.
- W stands for the system’s work relationship with its environment.
问题 5:在系统中,气体的压力保持恒定。系统周围环境中总共损失了 45 焦耳的热量。系统接收 450 J 的功。系统的内能是多少?
解决方案:
We know that equation of first law of motion;
ΔU = q+ w
ΔU = 45J + 450J
ΔU = 495J