冶金热力学原理
物理化学是物理和化学两个学科相结合的一个分支。这是热力学的概念走到尽头的时候。热力学是物理学的一个分支,研究热能(如热量)与其他类型的能量之间的联系。对发生在化学和物理转变过程中的能量转移的研究被称为热力学。它还使我们能够预测和跟踪这些变化。
冶金热力学
谈到冶金,吉布斯自由能是最重要的热力学概念。吉布斯自由能决定了一个过程在热力学中是否会自发发生。字母 ΔG。如果 ΔG 的值为负,则反应将自行发生。为了得到 ΔG,我们将看两个方程。
ΔG = ΔH – TΔS
焓的变化用ΔH表示。吸热反应用正值表示,而放热反应用负值表示。结果,当反应放热时,ΔG为负。熵,或分子的不可预测性,用字母 ΔS 表示。当事情的状态发生变化时,情况就会发生巨大变化。连接吉布斯自由能和平衡常数的另一个方程是
ΔG° = RTlnK eq
平衡常数为 K eq 。产物的活性质量除以反应物的活性质量得到这个数字。通用气体成分是 R。平衡值现在必须保持为正,以便获得负值 ΔG(这是可取的)。
埃林厄姆图
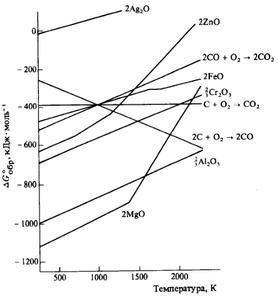
Ellingham 图描述了温度与化合物稳定性之间的关系。这是吉布斯能量流的图解说明。 Ellingham 图用于冶金学中绘制还原过程方程。这有助于我们确定还原氧化物以生产纯金属时使用的最佳还原剂。让我们来看看艾林汉姆图的一些最重要的特征。
- 在该图中,ΔG 与温度相关。熵由曲线的斜率表示,而焓由截距表示。
- 您可能知道,ΔH(焓)不受温度影响。
- 温度对 ΔS 没有影响,ΔS 是熵。但是,有一项规定是不应发生相移。
- 温度将绘制在 Y 轴上,而 ΔG 将绘制在 X 轴上。
- 图表底部附近有曲线的金属比上方的金属少见。
金属与空气的反应可归纳如下:
M(s) + O 2 (g) → MO(s)
在还原金属氧化物时,ΔH 通常始终为负(放热)。 ΔS 也是负数,因为我们在反应中从气态变为固态(如上所示)。结果,随着温度的升高,TΔS的值也升高,反应斜率升高。
来自 Ellingham 图的观察结果。
- 大多数金属氧化物生产的斜率是正的。可以解释如下。金属氧化物的产生会消耗氧气,从而降低不可预测性。结果,ΔS变为负,直线方程中的TΔS项变为正。
- 一氧化碳的形成由具有负斜率的直线表示。在这种情况下,ΔS 为正,因为消耗一摩尔氧气会导致形成两摩尔 CO 气体。这意味着 CO 在较高温度下变得更加稳定。
- 随着温度升高,用于产生金属氧化物的 ΔG 值变得不那么负值,直到它在某个点达到零。低于此温度,ΔG为负值,氧化物稳定;高于此温度,ΔG 为正,氧化物不稳定。这种总体模式表明,随着温度的升高,金属氧化物变得不太稳定并且更容易分解。
- 某些金属氧化物,如 MgO 和 HgO,在特定温度下斜率会发生急剧变化。这是因为相移(熔化或蒸发)。
艾林汉姆图的局限性
- Ellingham 图完全建立在热力学考虑之上。它提供了有关反应热力学可行性的信息。它没有提供有关反应速率的信息。此外,它没有提供其他反应发生概率的指示。
- 它还缺乏关于氧化物及其形成的全面信息。假设存在不止一种氧化物的可能性。此方案未在图中表示。
- ΔG 的解释是基于反应物和产物处于平衡状态的假设,这不一定是正确的。
埃林厄姆图的用途
- 在图表上,Ellingham 曲线低于大多数其他金属,例如铁。这有效地表明,图中所有高于其的金属都可以用作其氧化物的还原剂。由于氧化铝更稳定,因此在铝热法中用于提取铬。
- 高炉用于将铁与其氧化物分离。在熔炉中,矿石与焦炭和石灰石混合。氧化铁的还原发生在各种温度下。炉子底部的温度明显高于顶部。热力学被用来解释反应,这导致了这项技术的发展。
- 图的顶部是 Ag 2 O 和 HgO 形成的 Ellingham 图,击穿温度分别为 600 和 700 K。这意味着这些氧化物在低温下不稳定,即使不存在还原剂,也会在加热时分解。
- Ellingham 图用于预测用另一种金属的氧化物还原一种金属的氧化物的热力学可行性。任何金属都可以减少上图中其他金属的氧化物。例如,在 Ellingham 图中,氧化铬的形成高于铝,表明 Al 2 O 3比 Cr 2 O 3更稳定。因此,铝可以用作还原剂来还原氧化铬。然而,它不能用于减少镁和钙的氧化物,它们的位置比氧化铝低。
- 因为碳线穿过许多金属氧化物的线,它可以在足够高的温度下减少所有金属氧化物。让我们看一下碳还原氧化铁的热力学有利条件。大约 1000 K,产生 Fe2O 和 CO 的 Ellingham 图相交。低于此温度,碳线高于铁线,表明 FeO 比 CO 更稳定,因此在此温度范围内还原在热力学上不可行。然而,在 1000 K 以上,碳线低于铁线,使我们可以使用焦炭作为还原剂。随后的自由能计算证实了这种降低在热力学上是有利的。
示例问题
问题一:冶金是如何用于生产的?
回答:
In production engineering, metallurgy deals with the manufacturing of metallic components for use in technical or consumer products. Manufacturing, shape, heat treatment, and product surface treatment all fall under this category.
问题 2:什么是采掘冶金?
回答:
Extractive metallurgy is the process of removing valuable metals from an ore and purifying the retrieved raw metals into a purer form. The ore must be reduced physically, chemically, or electrolytically to convert a metal oxide or sulphide to a purer metal. The three principal streams of interest to extractive metallurgists are feed, concentrate (metal oxide/sulphide), and tailings (waste).
问题三:什么是冶金?
回答:
The physical and chemical properties of intermetallic compounds, metallic elements, and alloy mixes are studied in metallurgy, a branch of materials science and engineering. Metallurgy is the science and technology of metals, i.e. how science is used to metal manufacture and the engineering of metal components used in consumer and industrial products. Metallurgy is distinct from minecrafting as a skill. For technological advancement, metalworking is reliant on metallurgy, much as medicine is reliant on medical science.
问题 4:写一个关于金属及其合金的笔记
回答:
Aluminium, chromium, copper, iron, magnesium, nickel, titanium, zinc, and silicon are examples of engineering metals. These metals, with the exception of silicon, are the most typically used in alloys. Steels and cast irons are part of the iron-carbon alloy system, which has gotten a lot of attention. Plain carbon steels (those with almost all carbon as an alloying ingredient) are used in low-cost, high-strength applications where weight and corrosion aren’t an issue. Cast irons, such as ductile iron, are also part of the iron-carbon system. Iron-manganese-chromium alloys are used in non-magnetic applications such as directional drilling (Hadfield-type steels).
问题 5:Ellingham 图中有哪些重要的异常?
回答:
Following are some significant Exceptions in Ellingham Diagram:
- C(s) + O2 (g) → CO2 (g): Solids have a minimal entropy. As a result, one molecule of gas yields one molecule of gas. As a result, there is virtually little net entropy. As a result, there will be no slope and the surface will be perfectly horizontal.
- 2C (s)+ O2 (g) → 2CO (g): One mole of gas yields two moles of gas as a result of this reaction. As a result, the entropy will be positive in this case. As a result, this curve will begin to decline.