热力学第二定律
热力传递的方向和热机的效率受到热力学第二定律的约束。热力学的第一条规则说,宇宙的能量保持不变,即使能量可以跨系统和环境转移,但不会产生或破坏。
虽然热力学第一定律提供了有关过程中传递的能量数量的信息,但它不提供有关能量传递方向或传递的能量质量的任何信息。第一条定律没有解释温度均匀的金属棒如何在一端变得更热而在另一端变得更冷。法律只能宣布,如果这个过程发生,那么总会有能量平衡。
我们似乎从未变得更年轻。不管我们多么想要,我们都可以。我们打扫房间一次,然后它们很快又变得肮脏。某些事情只能以一种方式运作,而不能以另一种方式运作。热力学第二定律是确定一个过程是否可行的标准。一个过程的发生必须满足热力学的第一和第二原理。但它到底说了什么?让我们再看看它。
热力学第二定律
如果你曾经掉过一个杯子,看着它碎了,你就知道没有办法把完整的杯子拿回来。这就是不可逆的概念。根据热力学第二定律,如果不增加能量,热能不能从较低温度转移到较高温度。这就是为什么长时间运行空调是昂贵的。
According to the second rule of thermodynamics, any spontaneously occurring event will always result in an increase in the universe’s entropy. In basic terms, the law states that the entropy of an isolated system will never decrease over time.
在系统处于热力学平衡或经历可逆过程的某些情况下,系统及其周围环境的总熵保持不变。熵增定律是第二定律的另一个名称。
第二定律热力学的不同陈述
- 开尔文-普朗克声明
将加热体发出的所有热量都转化为功是很困难的。热机的工作材料从热体吸收热量,将一部分转化为功,然后将剩余部分返回到冷体。没有发动机可以在不浪费任何热量的情况下将来自源的所有热量转化为功。这表明需要接收器才能获得连续工作。
- 克劳修斯声明
不可能建立一种可以在不浪费任何能量的情况下将热量从较冷的物体传递到较温暖的物体的技术。换句话说,除非压缩机由外部电源供电,否则冰箱将无法工作。克劳修斯的断言被热泵和冰箱使用。
Equivalence of Two Statements:
A refrigerator, for example, can transfer a certain amount of heat from a cold body to a hot one without requiring any external energy. As a result, Clausius’ assertion is violated. Assume that an engine operating between the same hot and cold bodies absorbs heat from the hot body, transforms a portion W into work, and then transfers the remaining heat to the cold body.
The engine does not break the second law of thermodynamics on its own. When the engine and the refrigerator operate together, they create a mechanism that absorbs all of the heat from the hot body and transforms it into work without sacrificing any of the cold body’s heat. The Kelvin-Planck assertion is violated. As a result, we may conclude that the two versions of the second law of thermodynamics are equivalent in every way.
热力学第二定律方程
热力学第二定律在数学上表示为:
ΔS 单位> 0
在这里,ΔS univ是宇宙熵的变化。
让我们看看熵的定义以及它与热力学第二定律的关系。系统的熵定义为它从先前状态到当前状态所经历的变化次数。因此,熵通常表示为系统熵的变化,用 ΔS 表示。如果必须测量系统给定状态下的熵值,则为先前选择的系统状态分配零熵值。
等熵过程是系统的熵在整个时间内保持不变的过程。在等熵过程中,系统在开始和结束状态的熵保持不变。结果,在等熵过程中 S = 0。可逆等熵过程的发生只是一个理想过程。在实践中,只要系统状态发生变化,系统的熵就会上升。
封闭系统熵增的原因:
- 封闭系统的质量保持不变,尽管它可以与周围环境进行热交换。系统热含量的任何变化都会引起扰动,这往往会提高系统的熵。
- 由于系统分子运动的内部变化,系统内部存在干扰。这导致内部不可逆性和系统熵的增加。
第二类永动机(PMM2)
第二类永动机是一种在与单个储热器 (PMM2) 相互作用的同时产生功的设备。第二类永动机也是定义热力学第二定律的小工具。
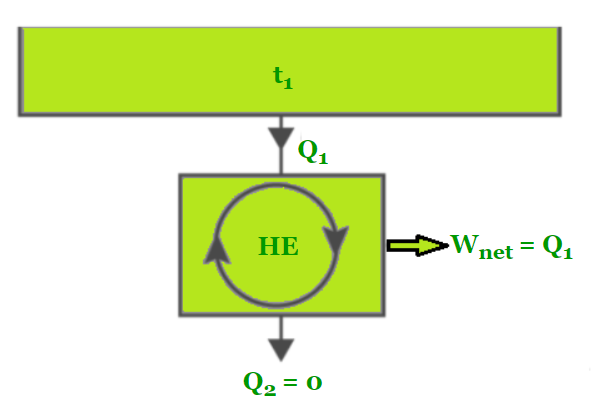
单热库
为了在循环中产生功,热机必须与至少两个不同温度的储热库相互作用。只要存在温差,就可以产生动力。如果与热机进行热交换的物体的热容量有限,则热机将产生功,直到两个物体的温度相等。
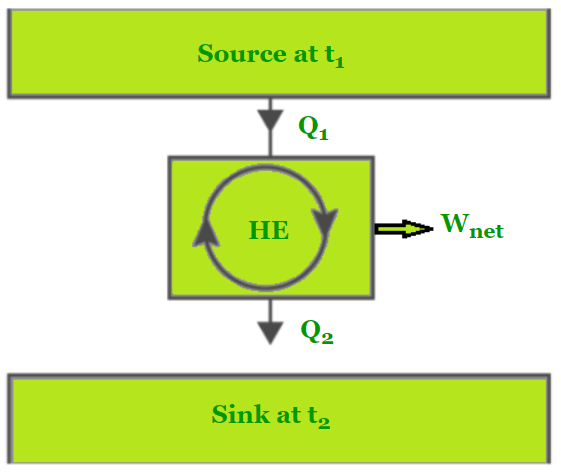
热机
示例问题
问题 1:热泵使用 500 J 的功从低温水库中带走 200 J 的热量。有多少热量传递到更高温度的储层?
回答:
Given:
Work, W = 500 J
Heat Removed, QC = 200 J
Heat Delivered, QH = W + QC
QH = 500 J + 200 J
QH = 700 J
Hence, the heat delivered to the higher temperature reservoir is 700 J.
问题2:热力学第二定律意味着什么?
回答:
It is impossible to convert all heat into labour, i.e., 100 % efficiency is impossible since it would result in a negative change in the entropy of the universe, which violates the Second Law of Thermodynamics.
问题 3:为了将热量转化为功,需要一个散热器或一种散热装置。上述推论基于哪条法律?
回答:
For the conversion of heat into work, a sink, or a mechanism that rejects heat, is required. Otherwise, the universe’s entropy will not change in a beneficial way. According to the second rule of thermodynamics, this is required.
问题 4:用熵的形式陈述热力学第二定律。
回答:
The second Law of Thermodynamics in terms of entropy can be stated as:
Every spontaneous or natural change increases the entropy of the cosmos. Heat movement in a system is always naturally from a higher temperature to a lower temperature. It is impossible for heat to move from a lower-temperature system to a higher-temperature one. All of the heat provided to the system in a cyclic process cannot be turned to work.
问题 5:举几个热力学第二定律的例子。
回答:
Few examples of the second law of thermodynamics are given as:
- Hot coffee cools down automatically.
- Air leaks from the balloon on its own.
- An object falls on the ground on its own.
- Two gases will mix automatically on their own.
- A gas takes the entire volume of the container.
- Water always flows from a higher level to the lower level.
- Ice melts automatically.