膦 – 结构、制备、性质、用途
P 块元素的最后一个电子进入它所在壳层的三个 p 轨道之一。有六组 p 块元素,因为 p 亚壳具有三个简并 p 轨道,每个轨道可以容纳两个电子。
由于它们倾向于失去电子,P 嵌段元素是有光泽的并且通常是强电和热的导体。在像镓这样的 P 块元素中,您可能会发现元素的一些惊人特性。它是一种金属,会在你的手掌中融化。因为硅是玻璃的关键成分,它也是 p 区组中最重要的准金属之一。
膦
磷化氢是一种磷氢化物,分子式为 PH 3 。磷化氢是一种易燃的危险气体。由于其重要的工业应用,它通常在企业和实验室中制造。
磷化氢可能存在于自然界的人类血液、尿液和唾液中。
膦的结构和分子式
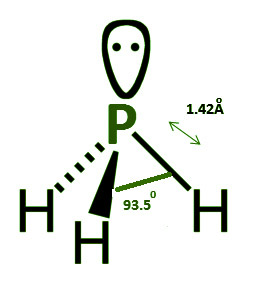
膦具有三角锥体结构。磷上存在的孤对电子导致分子的对称性改变。 sp 3杂交发生在磷中。存在三对束缚电子和一对孤对电子。 H-P-H 键的角度为93.5度,而 P-H 键的长度为 1.42 pm。
膦的制备
- 用磷化钙水解金属磷化物——金属磷化物与水或 HCl 反应生成磷化氢。
Ca 3 P 2 +6H 2 O→2PH 3 +3Ca(OH) 2
Ca 3 P 2 +6HCl→2PH 3 +3CaCl 2
- 由磷酸 -纯膦通过 H 3 PO 3的分解形成。
4H 3 PO 3 →3H 3 PO 4 +PH 3
- 从磷制备——在惰性 CO 2环境中在浓 NaOH 溶液中加热白磷产生 PH 3 。
P 4 +3NaOH+3H 2 OPH 3 +3NaH 2 PO 2
磷化氢的纯化
纯磷化氢是一种不易燃的物质。由于存在 P 2 H 4或 P 4蒸气,它变得可燃。通过在 HI 中吸收磷化氢并将其转化为 PH 4 l 来精制磷化氢。当你将它与氢氧化钾结合时,你会得到磷化氢。
PH 4 I+KOH→PH 3 +KI+H 2 O
膦的物理性质
- 这是一种非常危险的无色气体。
- 如前所述,纯形式的磷是不易燃的。然而,由于存在 P 4蒸气,它是可燃的。当磷与 HNO 3 、氯或溴蒸气等氧化性物质接触时,会着火。即使只有少量或微量的这些氧化化学物质存在,它也会着火。
- 它有一种明显的腐烂鱼腥味。
- 它只是微溶于水。
- 它的沸点为 –87.7 ∘摄氏度。
膦的化学性质
- 磷化氢与氨一样,是路易斯碱。当它与 HI、HBr 和 HCl 反应时,会生成鏻化合物。
PH 3 +Hl→PH 4升
PH 3 +HBr→PH 4溴
PH 3 +HCl→PH 4 Cl
- 可燃性-当磷燃烧时,会产生五氧化二磷和水。
2PH 3 +4O 2 →P 2 O 5 +3H 2 O
- 与氯反应
PH 3 +4Cl 2 →PCl 5 +3HCl
- 在正常情况下,它不会点燃。加热时会发生火焰爆炸,释放出磷酸。
- 当暴露于氧化性物质如 HNO 3 、Cl 2和 Br 2时,它会剧烈爆炸。
- 水中的PH 3遇光分解生成红色P和H 2 O。
PH 3(H2O) →P(红)+H 2 O
- 磷化氢被硫酸铜或氯化汞吸收后,会生成磷化铜和磷化汞。
3CuSO 4 +2PH 3 →Cu 3 P 2 +3H 2 SO 4
3HgCl 2 +2PH 3 →Hg 3 P 2 +6HCl
磷化氢的用途
- 磷化氢是一种用于制造金属磷化物的化学品。
- Holme 的信号和烟幕含有磷。
Holme’s signal:
The fact that phosphine spontaneously combusts makes it a likely candidate for use in Holme’s signal. When ships require assistance, calcium carbide and calcium phosphide-filled containers are pierced and tossed into the water. Acetylene and phosphine gases are produced as a result of the interaction with water. These gases emit a signal when they burn in the air.
Smoke screen:
When calcium phosphide is soaked in water, it creates a considerable amount of phosphine, resulting in a smoke screen. During the conflict, this was employed to hide the troops from the enemy.
In rodent and insect control formulations, phosphine fumigants are utilised.
示例问题
问题一:磷化氢的性质是什么?
回答
- Phosphine is a colourless, very toxic gas.
- It has a distinctive rotten-fish odour.
- It has a low water solubility.
问题二:磷化氢有什么用途?
回答
Phosphine is employed in the smoke screen, Holme’s signal, and insecticides and rodenticides as a fumigant.
问题3:膦的结构是什么?
回答
With a lone pair of electrons on P, the structure is trigonal bipyramidal. Three bound pairs and one lone pair of electrons are present. The angle of the connection is 93.5 degrees. The length of the P–H bond is 1.42 Armstrong.
问题四:实验室如何制备磷化氢气体?
回答
White phosphorus is burned with a strong NaOH solution in a CO2 inert environment to produce phosphine in the laboratory.
P4+3NaOH+3H2O→PH3+3NaH2PO2
问题五:如何提纯磷化氢?
回答
Phosphine is refined by absorbing impurities in HI, yielding PH4l, which is then treated with potassium hydroxide to get phosphine.
PH4l+KOH→KI+H2O+PH3
问题 6:什么是磷化氢?
回答
Phosphine has the formula PH3 and is a phosphorus hydride. Phosphine is a volatile and dangerous gas. Because of its vital industrial applications, it is routinely manufactured in businesses and laboratories.
In nature, phosphine may be found in human blood, urine, and saliva.