二氧化硫——结构、制备、性质、用途
跨越 13 到 18 族的p-block位于正常周期表的右侧。它们的电气配置通常为 ns 2 np 1-6 。尽管是第 18 族中的第一个元素,但氦不是 p 块的一部分。除第一行外,表中的每一行都有六个 p 元素。
唯一具有所有三类元素的块:金属、非金属和准金属就是这一块。在逐组的基础上,p 嵌段元素是第 13 组,二十几糖; 14、晶体素; 15、催吐素; 16、硫属元素; 17、卤素;和 18,氦组,包括惰性气体(氦除外)和 oganesson。 p-嵌段也可以定义为包括后过渡金属、准金属、反应性非金属(如卤素)和稀有气体。
二氧化硫
When sulphur-containing materials, such as metal, are heated, such as when smelting metal or burning coal or oil, sulphur dioxide is produced as a waste gas. It is a significant contaminant that is presently seen as a threat to the environment.
二氧化硫的结构
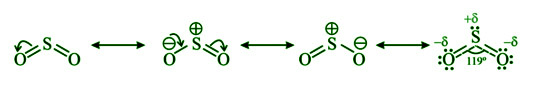
硫原子和两个氧原子之间的极性共价连接使二氧化硫具有扭曲的结构。 SO 2是二氧化硫的化学式。二氧化硫含有sp 2杂化硫。理想的键角应为 120°,而 O-S-O 键角为 119°。硫原子上的孤对电子导致了这一点。由于孤对-键对排斥,键角从120°减小到119°。
西格玛 (σ) 和 (π) 连接将二氧化硫分子中的每个氧原子连接到硫原子。 sp 2 -p 重叠形成硫原子和氧原子之间的 σ 键,而 π 键之一是由 pπ-pπ 重叠产生的,另一个是由 pπ-dπ 重叠产生的。
S 的电子配置是 1s 2 2s 2 2p 6 3s 2 3p 4 。
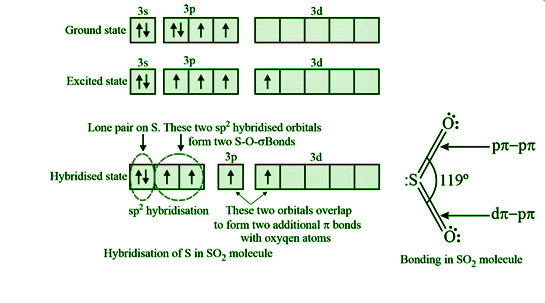
在SO 2的合成过程中,来自3p 轨道的一个电子移动到3d 轨道,S 发生sp 2杂化。其中两个轨道与两个氧原子有 sigma 键,而第三个轨道只有一对。每个 p 轨道和 d 轨道电子都是不成对的。一个电子与一个氧原子形成 pπ-pπ 键,而另一个电子与另一个形成 pπ-dπ 键。这就是SO 2具有143 pm 键长的弯曲结构的原因。
然而,由于共振,两个 S-O 键是相同的。
二氧化硫的制备
当硫在空气中燃烧时,会产生二氧化硫和微量三氧化硫 (6–8%)。
S(s)+O 2 (g) → SO 2 (g)
- 二氧化硫的实验室制备-二氧化硫是在实验室通过亚硫酸盐与稀硫酸反应制成的。该过程还产生硫酸钠和水作为副产品。
Na 2 SO 3 (s)+H 2 SO 4 (aq) → SO 2 (g)+Na 2 SO 4 (aq)+H 2 O(l)
铜屑在装有强硫酸的烧瓶中轻轻加热以产生二氧化硫。
Cu(s)+2H 2 SO 4 (aq)→SO 2 (g)+CuSO 4 (aq)+2H 2 O(l)
- 二氧化硫的工业制备-二氧化硫作为焙烧硫化矿石(如黄铁矿或锌混合物)的副产品在商业上产生。
4FeS 2 (s)+11O 2 (aq)→2Fe 2 O 3 (s)+8SO 2 (g)
二氧化硫的物理性质
- 二氧化硫是一种无色有毒气体,具有可怕的令人窒息的气味。
- 它的密度比空气低,易溶于水。在 0°C 时,一体积的水可以溶解大约 8 升气体。
- 它在环境温度和 2 个大气压下很容易液化。
- 它的沸点为 263K,冰点为 197.8K。
- 它是一种不易燃气体,可作为磷、硫和碘等物质的溶剂。
二氧化硫的化学性质
- 二氧化硫的酸性字符——二氧化硫与水反应生成亚硫酸。其酸性水溶液使蓝色石蕊呈深红色。结果,SO 2被归类为亚硫酸酐。
SO 2 (g)+H 2 O(l)→H 2 SO 3 (aq)
- 二氧化硫迅速与氢氧化钠溶液结合生成亚硫酸钠,然后再与额外的二氧化硫反应生成亚硫酸氢钠。
2NaOH(aq)+SO 2 (g)→Na 2 SO 3 (aq)+H 2 O(l)
Na 2 SO 3 (aq)+H 2 O(l)+SO 2 (g)→2NaHSO 3 (aq)
- 当二氧化硫气体通过石灰水时,溶液变成乳白色。当您通过过多的二氧化硫气体时,乳白色就会消失,因为会形成亚硫酸氢钙。
Ca(OH) 2 (aq)+SO 2 (g)→CaSO 3 (aq)+H 2 O(l)
CaSO 3 (aq)+H 2 O(l)+SO 2 (g)→Ca(HSO 3 ) 2 (aq)
- 与氧气结合-当二氧化硫被加热时,它与氧气相互作用生成三氧化硫。
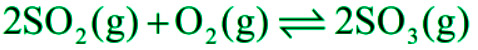
该反应在催化剂如镀铂石棉、五氧化二钒等存在下发生。当二氧化硫被加热时,它与氧气相互作用生成三氧化硫。
- 与卤素的反应——二氧化硫与卤素(氟、氯和溴)直接反应时变成硫酰氟、氯化物和溴化物。例如,在木炭的存在下,SO 2与氯反应形成硫酰氯。该反应通过使用木炭作为催化剂来辅助。
SO 2 (g)+Cl 2 (g)→SO 2 Cl 2 (l)
- 作为氧化剂- SO 2氧化强还原剂,如 H 2 S、HI、Mg、Fe 等,并且其自身被还原为硫或硫化物。
SO 2 (g)+2H 2 S(g)→2H 2 O(l)+3S
- SO 2作为还原剂-含水SO 2显示出还原字符,并且其自身被氧化成H 2 SO 4 。
酸化的橙色重铬酸钾溶液被还原为浅绿色的硫酸铬。
K 2 Cr 2 O 7 +H 2 SO 4 +3SO 2 →K 2 SO 4 +Cr 2 (SO 4 ) 3 +H 2 O
它降低了酸化的高锰酸钾溶液,释放出KMnO 4的粉红色。
2KMnO 4 +5SO 2 +2H 2 O → K 2 SO 4 +2MnSO 4 +2H 2 SO 4
- 作为漂白剂- 在存在水分的情况下,SO 2起到漂白剂的作用。它可能会漂白彩色羊毛、丝绸、花朵和头发等。二氧化硫的漂白作用是通过产生新生氢气来解释的,新生氢气将着色成分转化为无色还原的结果。
SO 2 +2H 2 O → H 2 SO 4 +2[H]
SO 2的漂白效果非常短暂。由于被空气氧化,漂白后的无色化学品在空气中会逐渐恢复原来的颜色。
Test of Sulphur Dioxide
The existence of this gas can be detected by reducing an acidified potassium permanganate solution. The pink colour of KMnO4 is released, indicating that sulphur dioxide gas is present.
2KMnO4+5SO2+2H2O → K2SO4+2MnSO4+2H2SO4
二氧化硫的用途
- 二氧化硫是硫酸的主要成分,硫酸是地球上使用最广泛的化学品之一。
- 它用于制造各种亚硫酸盐,包括亚硫酸氢钠、亚硫酸氢钙等。这些亚硫酸盐用于保持果酱、泡菜和果冻的新鲜。
- 二氧化硫是一种常见的杀虫剂,也可用于对木材或稻草等材料进行消毒。
- 它通过作为熏蒸剂杀死昆虫和其他害虫。
- 它用于提炼石油和糖,以及羊毛等对漂白敏感的织物。
- 二氧化硫也被用作抗氯剂或从漂白材料中去除过量氯的物质。
- 使用液态 SO 2可溶解多种有机和无机化合物。
- 它也被用来保持凉爽。
示例问题
问题一:二氧化硫是如何形成酸雨的?
回答:
When molecules like sulphur dioxide and nitrogen oxides are released into the air, a chemical reaction occurs, resulting in acid rain. Sulfuric and nitric acids are formed when these substances combine with water, oxygen, and other chemicals. Acid rain is formed when these acids fall to the earth.
问题二:二氧化硫有什么用途?
回答:
- Sulfur dioxide is the primary component of sulfuric acid, which is one of the world’s most commonly used chemicals.
- It’s utilised to create sulphites like sodium hydrogen sulphite and calcium hydrogen sulphite, among other things. Sulphites are employed to preserve the freshness of jams, pickles, and jellies.
- Sulfur dioxide is a widely used insecticide that may also be used to sterilise materials such as wood or straw.
- It acts as a fumigating agent, killing insects and other pests.
- It’s utilised in the refinement of petroleum and sugar, as well as the bleaching of delicate materials such as wool.
- Antichlor, or a chemical that eliminates excess chlorine from bleached materials, is also used with sulphur dioxide.
问题3:二氧化硫的物理性质是什么?
回答:
- Sulphur dioxide is a colourless, toxic gas having a foul, suffocating odour.
- Its density is lower than that of air, and it is easily soluble in water. One litre of gas may be dissolved in one litre of water at 0°C.
- At 2 atm pressure and ambient temperature, it is quickly liquified.
- It has a boiling point of 263K and a freezing point of 197.8K .
- It’s a non-flammable gas that may be used to dissolve phosphorus, sulphur, and iodine, among other substances.
问题4:二氧化硫与氯反应会发生什么?
回答:
Sulphuryl chloride is formed when SO2 interacts with chlorine in the presence of charcoal. The use of charcoal as a catalyst aids the process.
SO2(g) + Cl2 (g) → SO2Cl2 (l)
问题5:二氧化硫与氢氧化钠反应会发生什么?
回答:
Sulphur dioxide reacts fast with sodium hydroxide solution to form sodium sulphite, which is then combined with more sulphur dioxide to form sodium hydrogen sulphite.
2NaOH (aq) + SO2 (g) → Na2SO3 (aq) + H2O(l)
Na2SO3 (aq) + H2O (l) + SO2 (g) → 2NaHSO3 (aq)
问题 6:检测二氧化硫气体存在的确认试验是什么?
回答
The existence of this gas can be detected by reducing an acidified potassium permanganate solution. The pink colour of KMnO4 is released, indicating that sulphur dioxide gas is present.
2KMnO4+5SO2+2H2O → K2SO4+2MnSO4+2H2SO4