硫酸——结构、性质、用途
p 块元素中的最后一个电子进入它们各自壳层的三个 p 轨道之一。有六组 p 块元素,因为 p 亚壳具有三个简并 p 轨道,每个轨道可以容纳两个电子。因为它们倾向于失去一个电子,所以 P 块元素是有光泽的,通常是强电和热的导体。
硫酸
无机酸包括硫酸。一个硫原子、四个氧原子和两个氢原子组成了分子式。硫酸的化学式为 H 2 SO 4 。
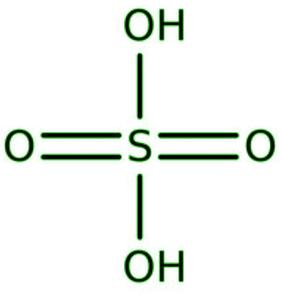
硫酸的结构
两个氢原子与硫酸中的两个氧原子紧密相连,产生两个羟基。该分子具有四面体结构并且是共价的。

硫酸的分子量
硫酸的化学式为 H 2 SO 4 。根据该式,一分子硫酸(H 2 SO 4 )包含2摩尔氢、1摩尔硫和4摩尔氧原子。结果,H 2 SO 4的分子量将等于两摩尔氢、一摩尔硫和四摩尔氧的质量之和。因为氢的原子质量为 1u,硫的原子质量为 32u,氧的原子质量为 16u,所以硫酸的分子质量可以计算如下:
The molecular mass of H2SO4= Mass of 2 moles of hydrogen atoms + Mass of 1 mole of sulphur + Mass of 4 moles of oxygen atoms
= 2×1+32+4×16
= 2+32+64
= 98u
Thus, the molecular mass of sulphuric acid is 98u and the molecular weight of sulphuric acid is 98g/mol.
硫酸当量
结合或置换 1 份氢、8 份氧或 35.5 份氯的元素/化合物/离子的质量称为当量。任何化合物的当量,特别是酸和碱,都取决于其使用的过程。任何化合物的当量重量,尤其是酸和碱,取决于它所用于的反应。
当量 = 分子量 / 可替换的 H +离子数。
- 硫酸的分子量为98g。
- 硫酸有两个可替换的 H +离子。
- 通过应用上述等式中的值
- 当量重量=982=49g。
- 硫酸的当量重量为49g。
硫酸的制造
接触过程包括硫酸生产的三个阶段:
- 二氧化硫是通过在空气中燃烧硫磺或硫化矿石而产生的。
- 在催化剂存在下二氧化硫与氧气的相互作用将其转化为三氧化硫 (SO 3 ) (V 2 O 5 )。
- SO 3在H 2 SO 4中的吸收产生发烟硫酸。
从生成的 SO 2中去除灰尘和其他污染物,例如砷化合物。在V 2 O 5存在下用O 2催化氧化SO 2以产生SO 2是生产H 2 SO 4 (催化剂)的关键步骤。
2SO 2 (g)+O 2 (g)→2SO 3 (g)
正向反应是放热的、可逆的,并导致体积减小。因此,低温和高压是最大化产量的理想选择。但温度不宜过低;否则,反应将需要很长时间才能完成。
该装置在 2 bar 的压力和 720 K 的温度下运行。当来自催化转化器的 SO 3气体被浓缩的 H 2 SO 4吸收时,会产生发烟硫酸。通过用水稀释发烟硫酸来获得适当浓度的 H 2 SO 4 。因此,该行业同时进行了两个阶段,以提高流程的效率和成本效益。
SO 3 +H 2 SO 4 →H 2 S 2 O 7 (发烟硫酸)
通过接触工艺获得的硫酸纯度为 96–98%。
硫酸的物理性质
- 在 288 K 时,纯硫酸是一种无色粘稠油状液体,比重为 1.84。
- 在所有浓度下,它都溶于水。
- 它创造了一个不断沸腾的组合。该组合含有 97.3% 的酸,沸点为 611 开尔文。结果,沸腾不能将硫酸水溶液浓缩到超过 97.3%。
- 在潮湿的空气中,会产生大量烟雾。
- 当它与皮肤接触时,会产生严重的灼伤。
硫酸的化学性质
- 解离- 当纯无水硫酸煮熟时,会形成三氧化硫和水。
H 2 SO 4 →SO 3 +H 2 O
- 硫酸的酸性字符-它是一种常见的二元酸,当暴露于它时会变成蓝色石蕊呈深红色。它分为两组盐。
NaOH+H 2 SO 4 →NaHSO 4 +H 2 O
2NaOH+H 2 SO 4 →Na 2 SO 4 +2H 2 O
- 硫酸的磺化作用——例如,浓硫酸与多种有机分子(如苯、甲苯等)结合形成磺酸。
C 6 H 6 +H 2 SO 4 →C 6 H 5 SO 3 H+H 2 O
- 与硫酸的沉淀反应 -例如,当使用钡、铅和其他盐的水溶液处理时,会产生不溶性硫酸盐沉淀。
H 2 SO 4 +BaCl 2 →BaSO 4 ↓+2HCl
- 与三氧化硫反应——发烟硫酸,俗称发烟硫酸,在溶解三氧化硫时形成。
H 2 SO 4 +SO 3 →H 2 S 2 O 7
硫酸的用途
- 硫酸铵、过磷酸钙等肥料就是用这种方法制造的。
- 用于生产颜料、炸药和药品。
- HNO 3用于生产酸,例如 HCl 和 HNO 3 。
- 例如,在颜料、油漆和聚合物的生产中。
- 例如,在造纸和纺织行业。
- 硝酸纤维素用于商品生产。
- 冶金应用(例如:在上釉、电镀和镀锌前清洁金属)。
- 在皮革行业。
- 在储藏室中。
- 在石油和天然气领域。
- 在洗涤剂业务中。
- 它用作脱水器。
- 作为实验室的试剂。
示例问题
问题一:硫酸有什么用途?
回答:
Fertilizers, dyestuffs, explosives, and pharmaceuticals are all made with sulphuric acid. It is also used to make acids such as HCl and HNO3. It’s frequently utilised in the metallurgical industry (Example: Cleaning metals before enamelling, electroplating and galvanising).
问题二:为什么硫酸被称为化工之王?
回答:
Sulphuric acid, sometimes known as the “king of chemicals,” is one of the most significant substances. It’s also known as vitriol oil since it used to be made from green vitriol back in the day. It is very corrosive and more reactive than other acids. As a result, it has a wide range of uses, including usage in laboratories, batteries, detergents, and the manufacture of numerous medications.
问题3:当硫酸与钡盐的水溶液反应时会发生什么?
回答:
It generates insoluble sulphates that precipitate when handled with aqueous solutions of barium salts.
H2SO4+BaCl2→BaSO4↓+2HCl
问题4:硫酸与三氧化硫反应会发生什么?
回答:
Sulphuric acid dissolves sulphur trioxide to generate oleum, often known as fuming sulphuric acid.
H2SO4+SO3→H2S2O7
问题5:硫酸的结构是什么?
回答:
In sulphuric acid, two hydrogen atoms are firmly bonded to two oxygen atoms, resulting in two-OH groups. The molecule is covalent and has a tetrahedral structure.
