烷烃——定义、命名、制备、性质
在自然科学中,碳氢化合物是完全由氢和碳组成的天然原子。碳氢化合物是收集 14 种氢化物的例证。碳氢化合物是沉闷和疏水的,带有轻微的气味。由于他们多样化的复合设计,很难再总结。大部分人为碳氢化合物排放来自石油衍生物的复制,其中包括燃料的产生和点火。乙烯、异戊二烯和单萜主要是在植物散发物中发现的正常碳氢化合物。
什么是烷烃?
Alkanes are organic compounds made up of carbon and hydrogen atoms that are single-bonded. Alkanes have the formula CnH2n+2 and are classified into three groups:
- Chain alkanes,
- Cycloalkanes, and
- Branched alkanes.
烷烃是一类在碳和氢原子之间只有一个共价键的化合物。碳和氢原子之间的单个共价键构成了这类化合物。通过煤的干馏产生的煤气、LPG(液化石油气)和 CNG(压缩天然气)是燃料的例子。此外,煤油被用作家用燃料。所有这些燃料均由碳氢化合物组合而成,碳氢化合物是能源。
烷烃的命名
C n H 2n+2是烷烃的通式,n=1、2、3、4,以此类推。烷烃在 IUPAC 系统中有一个后缀,前缀由碳原子数决定。以下是一些饱和烃的名称:
Number of Carbon Atoms | Formula | IUPAC Name |
1 | CH4 | Methane |
2 | C2H6 | Ethane |
3 | C3H8 | Propane |
4 | C4H10 | Butane |
5 | C5H12 | Pentane |
6 | C6H14 | Hexane |
7 | C7H16 | Heptane |
8 | C8H18 | Octane |
9 | C9H20 | Nonane |
10 | C10H22 | Decane |
烷烃异构
因为只有一种方法可以连接 1、2 和 3 个碳原子,所以前三种烷烃、甲烷、乙烷和丙烷只有一种结构。另一方面,丁烷可以有两种异构体。

烷烃的异构:丁烷
戊烷包含三种异构体,因为五个碳原子可能以三种不同的方式连接。
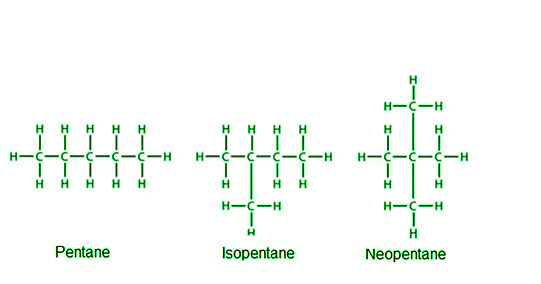
烷烃的异构:戊烷
己烷有五种异构体,庚烷有九种,辛烷有十八种,壬烷有三十五种,癸烷有七十五种。
烷烃的制备
不饱和烃的加氢或还原是在催化剂存在下向不饱和烃中添加氢气的过程。
C 2 H 4 + H 2 → C 2 H 6
C 3 H 6 + H 2 → C 3 H 8
来自卤代烷
以下任何技术都可用于将卤代烷转化为烷烃:
- 格氏试剂:当烷基卤化物,特别是溴化物和碘化物,在无水乙氧基乙烷(乙醚)存在下与金属镁结合时,会形成烷基卤化镁。当烷基卤化镁与水结合时形成烷烃。
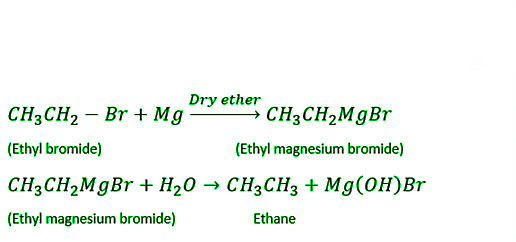
使用烷基卤化物制备烷烃:格氏试剂
- 通过 Wurtz 反应:当烷基卤化物,特别是溴化物和碘化物在无水乙醚存在下用金属钠处理时,烷烃的合成增加。

使用烷基卤化物制备烷烃:Wurtz 反应
从羧酸
以下任何程序均可用于生产烷烃。
- 脱羧:这是在实验室完成的烷烃制备过程。当羧酸与钠钙 (NaOH + CaO) 在 630 K 左右加热时,会损失一个二氧化碳分子,并生成碳原子少于羧酸的烷烃。
从羧酸制备烷烃:脱羧
- Kolbe 电解法:当使用浓缩的钾或钠水溶液时。

羧酸制备烷烃:科尔贝电解法
烷烃的物理性质
分子间的吸引力决定了烷烃的物理特性。让我们看一下其中的一些属性:
- 沸点- 直链烷烃随着分子量的增加而具有更高的沸点。这是由于分子大小和分子表面积的增加,从而提高了范德华引力的大小,从而提高了沸点。直链烷烃的前四个成员是气体,接下来的十三个成员是液体,上面的成员是无色蜡状固体。

- 熔点——烷烃的熔点与其沸点相同。随着分子量的增加,烷烃的熔点升高。烷烃的熔点取决于它们的形式和大小,以及它们的分子密度。结果,发现偶数烷烃比奇数烷烃具有更大的熔点趋势。

- 溶解性-由于碳和氢之间的微小电负性以及C-C键和C-H键的共价性质,烷烃是非极性颗粒。烷烃不溶于水、液体等极性溶剂,但在非极性溶剂(如汽油、乙醚、苯、四氯化碳等)中具有极强的溶解性。
- 密度 -烷烃的密度随着亚原子质量的增加而增加,尽可能达到 0.8 g cm -3 ,这意味着所有烷烃都比水轻。
烷烃的反应
- 取代反应-当烃中的氢原子被一个原子或一组原子取代时,就会发生取代反应。因为 C-C 和 C-H 有一个 sigma 键,烷烃只发生取代反应。以下是一些取代反应的例子:
- 卤化-卤化是将氢原子与卤素(如 F、Cl、Br、l)交换的过程。它可以通过将混合物加热到 520 到 670 摄氏度或使用紫外线辐射来完成。
- 硝化-硝化是用硝基取代氢原子的过程。烷烃在通常温度下不与硝酸反应,但当烷烃和发烟 HNO 3蒸汽的混合物在压力下加热到 423 – 673 K 时,烷烃会被硝化。
CH 4 HNO 3 → CH 3 –NO 2 + H 2 O
- 氧化- 烷烃在加热时在空气中燃烧,产生二氧化碳和水。这是燃烧过程,导致释放大量热能。
CH 4 +2O 2 →2CO 2 +H 2 O; ΔcH∘ = –80KJmol –1
当烷烃在氧气不足的情况下加热时,会发生不完全燃烧,产生一氧化碳和未燃烧的碳。
2CH 4 + 3O 2 → 2CO + 4H 2 O;
CH 4 +O 2 →C+2H 2 O
烷烃的用途
- 天然气由甲烷组成。在家庭和企业中,液化石油气(丁烷和异丁烷的组合)都被用作燃料。
- 用于印刷油墨、油漆和汽车轮胎的炭黑是由烷烃制成的。
- 醇、醛和羧酸是通过烷烃的催化氧化产生的。
- 汽油、煤油、柴油、润滑油和石蜡都是高级烷烃的例子。
- 某些卤素衍生物,如氯仿和四氯化碳,由烷烃制成,在工业和实验室中用作溶剂。
示例问题
问题1:烷烃的性质是什么?
回答:
Alkanes have three physical properties: they have a high melting point, a high boiling temperature, and they are soluble in non-polar solvents but insoluble in polar solvents.
问题 2:前四种烷烃是什么?
回答:
The first four alkanes are methane (CH4), ethane (C2H6), propane (C3H8), and butane (C4H10). The simplest alkane is methane gas, which has the chemical formula CH4.
问题3:什么是卤化?
回答:
Halogenation is the process of exchanging a hydrogen atom with a halogen such as F, Cl, Br, l. It can be done by heating the mixture between 520 and 670 degrees Celsius, or by using UV radiation.
问题4:什么是硝化?
回答:
Nitration is the process of replacing a hydrogen atom with a nitro group. Alkanes do not react with nitric acid at usual temperatures, but when a combination of an alkane and fuming HNO3 vapours is heated at 423–673k under pressure, alkanes are nitrated.
CH4HNO3 → CH3–NO2 + H2O
问题5:为什么烷烃不溶于水?
回答:
Due to the tiny electronegativity among carbon and hydrogen and the covalent property of the C–C bond and C–H bond, alkanes are non-polar sort of particles. Alkanes are insoluble in polar solvents like water, liquor, and so forth, however are profoundly dissolvable in non-polar solvents like petrol, ether, benzene, carbon tetrachloride, and so on .