氨——结构、性质、制备、用途
p-block位于正常元素周期表的右侧,包含 13 到 18 族的元素。它们的 ns 2 np 1-6电气配置。 p 块不包括氦,尽管它是第 18 组中的第一个元素。除了第一行,表中的每一行都有六个 p 元素(没有)。
金属、非金属和准金属都存在于这个块中,这使得它独一无二。第 13 组,二十碳烷; 14、晶体素; 15、催吐素; 16、硫属元素; 17、卤素;和 18,氦组,由惰性气体(氦除外)和 oganesson 组成。
什么是氨?
氨是基于氮和氢的化学物质。它由一个氮原子和三个氢原子组成。 NH 3是它的化学式。动植物体的自然分解会产生氨,因为其中的氮化合物在它们死亡或腐烂时会分解,从而产生氨。氨也可以作为铵盐存在于土壤中。
含氮有机物尿素(NH 2 CONH 2 )分解生成氨。
NH 2 CONH 2 + 2H 2 O → (NH 4 ) 2 CO 3 ⇌ 2NH 3 + CO 2 + H 2 O
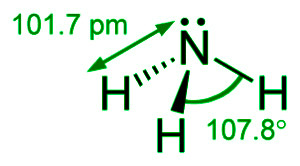
氨的结构
当氮的三个 sp 3杂化轨道和氢的三个 s 轨道发生碰撞时,就会产生氨分子。一对孤电子占据氮的 4 th sp 3杂化轨道。因此氨分子具有三角锥结构。
HNH 角为 107.8 ∘ ,而 NH 键长为 101.7 pm。由于孤对 - 键对排斥,倾向于将NH键略微向内推,HNH键角略小于109 ∘ 28'的四面体角。由于氢键,氨以液体和固体形式连接。
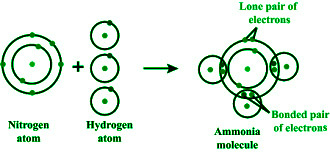
氨分子的形成
氨的物理性质
- 氨是一种无色气体,具有明显的刺激性气味,称为氨气味。
- 因为它比空气轻,所以它通过向下的空气置换聚集。
- 当快速吸入时,它会导致眼泪涌出眼睛。
- 如果施加 8 到 10 个大气压的压力,它在室温下很容易液化。
- 在 1 个大气压下,液态氨的沸点为–33.5 ∘ C(239.6K)。它具有高汽化焓 (1370J/g),因此用于制冰设备和制冷系统。
- 在 –77.8°C (195.3°K) 时,液氨冻结成白色结晶固体。
- 它具有高水溶性。一体积的水溶解大约 1300 体积的氨气。由于其高水溶性,氨气不能在水中收集。
氨的制备
- 使用强碱加热铵盐:氨是通过用强碱加热铵盐小规模制备的。
(NH 4 ) 2 SO 4 +2NaOH+加热→2NH 3 +2H 2 O+Na 2 SO 4
NH 4 Cl+KOH+加热→NH 3 +H 2 O+KCl
- 氨是在实验室中通过加热熟石灰和氯化铵的混合物制成的。
2NH 4 Cl+Ca(OH) 2 +加热→2NH 3 +2H 2 O+CaCl 2
- 金属氮化物,如氮化镁和氮化铝,用水或碱水解,也可产生氨气。
Mg 3 N 2 +6H 2 O→2NH 3 +3Mg(OH) 2
AlN+3H 2 O→NH 3 +Al(OH) 3
通过将氨气通过生石灰,将其干燥(CaO)。由于氨是一种碱性气体,它不能通过浓硫酸或五氧化二磷进行干燥,因为它会与它们反应生成硫酸铵或磷酸铵。氯化钙不能用于干燥氨气,因为氯化钙会产生氨化物。
哈伯法生产氨
在商业规模上,氨是通过 Haber 工艺制造的。
N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (g) ; ΔH ∘ = –92.4kJ /mol
这是体积减小时发生的可逆放热反应。因此,根据 Le Chatelier 原理,生产氨的最佳条件是:
- 低温:因为正向过程是放热的,所以在低温下有利于氨的生成。然而,反应速率在低温下会很慢。该反应的最佳温度已确定为 700K 左右。
- 高压将有利于氨的产生,因为正向反应随着体积的减少而发生。在200×10 5 Pa(200个大气压)的压力下,反应通常进行。
- 催化剂:反应速度比较慢,大概在700K左右。氧化铁与少量的 K 2 O 和 Al 2 O 3一起用作催化剂。添加钼作为促进剂提高了催化剂的效率。
Haber 的技术以 1:3 的摩尔比将 N 2和 H 2的混合物压缩到大约 200 个大气压的压力。冷却后,压缩气体通过碱石灰塔输送以去除水分和二氧化碳。然后将它们送入含有氧化铁、少量k 2 O和Al 2 O 3的催化剂室中。当两种气体结合生成氨时,腔室被电加热到 700K 的温度。由于该过程是放热的,因此产生的热量将温度保持在所需水平,无需额外的电加热。
从腔室中渗出的气体中含有大约 15-20% 的氨,其余的是没有反应的氮气和氢气。它们通过冷凝管,冷凝管将接收器中的氨液化并收集起来。未反应的气体被泵回压缩泵,在那里它们与新的气体组合混合。
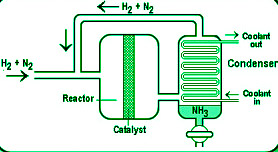
哈伯过程
氨的化学性质
- 由于其基本组成,氨极易溶于水。由于产生OH-离子,其水溶液呈弱碱性。
NH 3 (g)+H 2 O(I) ⇋ NH 4 OH(aq) ⇋ NH 4 + (aq)+OH - (aq)
因为它是碱性的,它会将潮湿的红色石蕊花变成蓝色,并中和干湿状态下的酸,生成相应的盐。
NH 3 +HCl → NH 4 Cl
2NH 4 OH+H 2 SO 4 → (NH 4 ) 2 SO 4 +2H 2 O
- 由于氮原子上存在孤对电子,氨起到路易斯碱的作用。因此,它可以很容易地提供其电子对与缺电子化合物如BF 3或具有未占据d-轨道的过渡金属阳离子建立配位键以形成配合物。举个例子,
Ag + (aq)+2NH 3 (aq) → [Ag(NH 3 ) 2 ] + (aq)
Cu 2+ (aq)+4NH 3 (aq) → [Cu(NH 3 ) 4 ] 2+ (aq)
因此,氨作为配体。
- 在燃烧方面,氨既不是燃料也不是燃料支持者。然而,在氧气存在的情况下,它会产生氮气和水。
4NH 3 +3O 2 →2 N 2 +6H 2 O
- 氨通过次氯酸钙(漂白粉)、溴水或加热的氧化铜溶液时会被氧化成氮气。
4NH 3 +3Ca(OCl) 2 → 2 N 2 +3CaCl 2 +6H 2 O
8NH 3 +3Br 2 → N 2 +6NH 4 Br
2NH 3 +3CuO+加热→3Cu+N 2 +3H 2 O
当氨在 500 K 和 9 bar 的压力和过量空气下通过 Pt/Rh 纱布时,氨被氧化成一氧化氮。 Ostwald 的技术使用该反应作为制造硝酸的起点。
氨的用途
以下是氨的许多用途:
- 在奥斯特瓦尔德的硝酸合成过程中。
- 在碳酸钠的制造中,使用了索尔维工艺。
- 用于生产人造丝和尿素。
- 生产硫酸铵、硝酸铵、尿素、磷酸二铵和其他肥料。
- 在制冰厂作为制冷剂。
- 可以用它清洁家具和玻璃表面。
- 在实验室中,它被用作溶剂和试剂。
示例问题
问题一:氨的性质是什么?
回答:
Ammonia is a colourless gas with a distinctive pungent ammoniacal odour. It is lighter than air and may easily liquefy at room temperature when subjected to a pressure of 8 to 10 atmospheres. Under one atmosphere pressure, its boiling point is –33.5∘C(239.6K). It serves as a Lewis foundation.
问题2:氨的制备方法是什么?
回答:
Haber’s technology is used to produce ammonia on a commercial basis.
N2 (g) + 3H2 ⇌ NH3 (g) ; ΔH∘=–92.4kJ/mol
This reaction is carried out in the presence of iron oxide as a catalyst with a little amount of K2O and Al2O3 at a temperature of 700K and a pressure of 200×105Pa or 200 atmospheres. Molybdenum is utilised as a promoter to improve the catalyst’s efficiency.
问题3:合成氨有什么用途?
回答:
Synthetic ammonia is mostly used to make fertilizers including ammonium sulphate, ammonium nitrate, urea, and diammonium phosphate. Apart from that, it’s employed in the production of nitric acid via Ostwald’s process, sodium carbonate via Solvay’s process, and rayon and urea via Solvay’s process.
问题四:氨水有什么用途?
回答:
Ammonia is used as:
- In the production of nitric acid by Ostwald’s process, sodium carbonate by Solvay’s process, and rayon and urea by Solvay’s process.
- In the production of fertilizers such ammonium sulphate, ammonium nitrate, urea, and diammonium phosphate, among others.
- In ice plants as a refrigerant.
- As a surface cleaner for furniture and glass.
- In the laboratory, it is utilised as a solvent and as a reagent.
问题5:哈伯法合成氨是什么反应?
回答:
Haber’s technique produces ammonia through a reversible, exothermic reaction that results in a drop in volume. We hope you found this ammonia post useful. If you have any questions, please leave a comment below and we will respond as soon as possible.