汤姆森的原子模型
物质被定义为占据空间的一切。空气和水、糖和沙子、氢气和氧气等都属于物质。此外,物质也是由小颗粒组成的。由于物质占据了如此多的空间,并且是我们日常生活的一部分,因此人们必须热衷于观察它的构成是很自然的。科学家们一直热衷于收集有关物质结构和组成的信息。公元前 500 年的一位哲学家断言,在将物质分割成越来越小的粒子时,最终,这些粒子将不可能进一步分割的时刻到来。其他哲学家说,当这些粒子粘在一起时,会导致我们在我们周围看到的所有形式的物质的形成。随之而来的一些希腊哲学家支持同样的理论,并将这种粒子命名为“原子”。因此,原子是宇宙中存在的最基本、最基本的单位。
原子堆叠在一起形成我们周围的各种形状。它们是这个星球上所有生物和非生物形式的基本组成部分。由于原子对我们的存在至关重要,因此有必要了解它们的功能、结构和性质。在化学中,研究原子的结构总是结合历史背景,即各种科学家提出的各种理论,他们的假设、缺点、推论等。原子的结构不是由一个科学家通过单实验。这是一个漫长的过程,涉及不同学者的无数实验,每个人都提出了自己的结果和理论,直到其他科学家的理论与他的理论相矛盾。在发现原子内部的粒子之前,科学家们一直坚信原子是不可分割的。我们将在下面详细讨论所有这些。
让我们讨论一些与原子相关的重要术语:
- 电子:电子是原子中带负电的粒子,仅占原子质量的一小部分。它们围绕原子的质子(带正电的粒子)和中子(中性粒子)旋转。如果一个原子失去或获得电子,它就会变成一个离子。
- 质子:质子是原子中的带正电粒子,比电子重约 1840 倍。质子与中子一起形成原子核,原子的电子围绕着原子核旋转。
- 中子:中子是那些不带电荷且质量略大于质子的亚原子粒子。中子和质子一起形成原子核。原子核的稳定性需要中子。
- 核:原子核是一个由原子质子和中子组成的小而密集的区域,电子围绕该区域旋转。
早期研究:道尔顿的原子论
在发现原子时,人们普遍接受并同意它们不能再进一步划分。英国化学家约翰道尔顿提供了关于物质性质的基本理论。他赞同原子在自然界中不可分割和不可破坏的观点。他的理论基于以下两个化学结合定律:
- 质量守恒定律:在化学反应中,质量既不能产生也不能破坏,前提是化学系统与外界的各种能量和热量隔绝。因此,质量的量随时间守恒。
- 恒比例定律:它指出,在化学物质中,元素总是以一定的质量比例存在。这意味着化合物的任何纯样品将始终由以相同质量比存在的相同元素组成。
道尔顿的原子论对上述两条定律都给出了准确的解释。这是物质研究的一个转折点。根据道尔顿的原子理论,所有物质,无论是元素、化合物还是混合物,都是由称为原子的小粒子组成的。
道尔顿原子论的公设
- 原子是构成我们周围所有物质的微小粒子。
- 原子是不可分割的粒子。
- 原子不能在化学反应中产生或破坏。
- 给定元素的原子在质量和化学性质上是相同的。
- 不同元素的原子具有不同的质量和化学性质。
- 原子以小整数的比例结合形成化合物。
- 在给定的化合物中,原子的相对数量和种类是恒定的。
电子和质子的发现:道尔顿原子理论的失败
道尔顿的原子理论无法解释不同形式物质的电传导。对静电的研究证明了原子不可分割的观点是错误的。一种物质要导电,它需要有一个电荷,无论是正电荷还是负电荷。由于所有物质都是由原子组成的,并且所有物质都可以导电,因此很明显原子是带电粒子。
1886 年,E. Goldstein 发现气体放电中存在带正电的辐射,并将其称为管射线。这些射线最终导致发现了一种名为质子的亚原子粒子,它带有正电荷。 1900 年,JJ Thomson 提出原子内部存在带负电的粒子,其大小与质子的大小相等但符号相反。道尔顿的原子理论指出,原子是不可分割和不可破坏的。但是原子内部电子和质子的发现导致了这一理论的失败。人们对这些粒子在原子内的排列方式产生了好奇。因此,许多科学家提出了各种原子模型。 JJ Thomson 是第一个这样做的人。
原子结构:在原子内部发现了两个基本粒子(电子和质子),导致道尔顿原子理论的失败。然后认为有必要知道电子和质子在原子内是如何排列的。为了解释这一点,许多科学家提出了各种原子模型。 JJ Thomson 是第一个提出原子结构模型的人。
汤姆森的原子模型
1897 年,汤姆森声称原子的基本体是球形的,其中包含电子(原子内产生负电荷的微小粒子)和围绕电子的带正电荷的“果冻”,可中和电子的电荷。这是约翰道尔顿理论的一部分被推翻的时候,因为它指出当汤姆森发现原子有更多部分是电子时,原子在自然界中是不可分割的!因此,JJ Thomson 在 1897 年发现了第一个亚原子粒子电子和他的新模型!汤姆逊还为发现同位素和具有不同原子量的同一元素的原子做出了贡献。
许多科学家对原子结构提出了不同的想法和解释。最基本的模型是由一位名叫 JJ Thomson 的科学家介绍的。该模型从理论上解释了原子内部结构的描述。尽管汤姆森模型不是解释原子结构的准确模型,但它被证明是其他原子模型发展的基础。
汤姆森认为,原子是嵌入了电子的带正电物质的均匀球体。通常被称为葡萄干布丁模型,由于理论和实验原因,它不得不被放弃(1911 年),转而支持卢瑟福原子模型,其中电子描述了围绕一个小的正核的轨道。汤姆森的原子模型,威廉汤姆森(也称为开尔文勋爵)将原子想象成一个球体,正电荷均匀分布,并嵌入足够的电子以中和正电荷。
观察:根据汤姆森的模型,原子在结构上就像一个李子布丁。他认为电子就像带正电荷的球体中的干果,代表布丁。我们也可以在这里比较一个西瓜,正电荷散布在西瓜的可食用部分,像种子一样的电子散布在那个球体中,如下图所示:
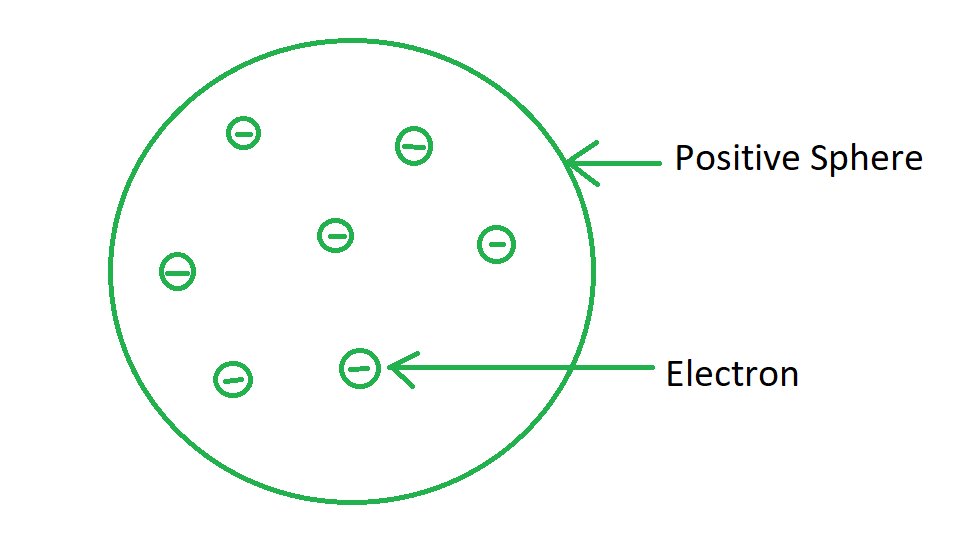
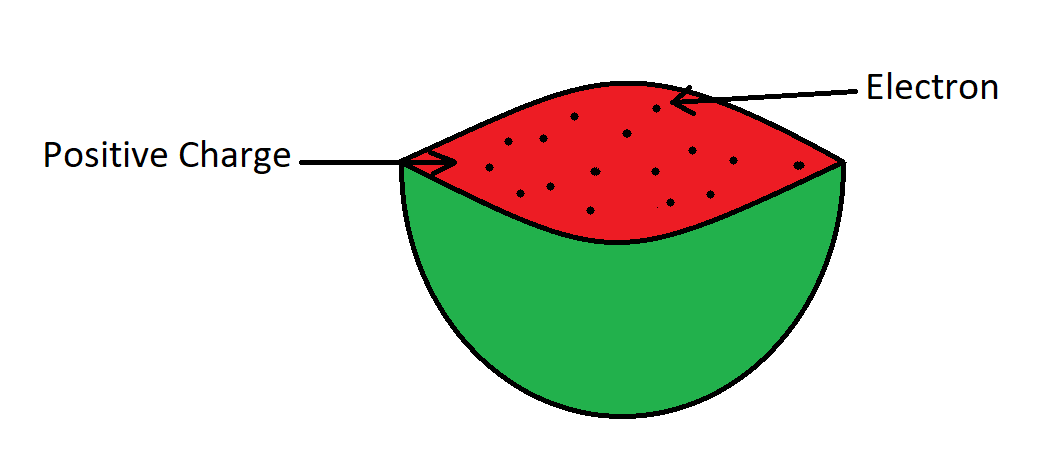
也可以说,电子随机嵌入在一个含有正电荷的球体中。托马斯断言,正电荷和负电荷的大小相等,因此相互抵消了作用,并使原子中和。
汤姆森原子模型的公设
- 原子带中性电荷。
- 有一个正电荷源可以中和电子的负电荷。
- 这种正电荷均匀地分布在原子中。
- 用汤姆森的话来说:“带负电的微粒”,即电子,包含在均匀的正电荷质量中。
- 电子可以在原子内部自由漂移。
- 电子具有稳定的轨道,这是基于高斯定律的论点。如果电子通过正“质量”移动,则电子内的内力与在轨道周围自动产生的正电荷平衡。
- JJ Thomson 的原子模型在英国被普遍称为李子布丁模型,因为 Thomson 提出的电子分布类似于李子在甜点中的排列。
汤姆森原子模型的局限性
- 这个模型是所有其他模型中最基本的。它有很多缺点,但它确实引起了其他科学家的好奇心,并为该领域的更多突破性发现铺平了道路。
- 该模型没有提到原子中存在原子核。
- 它未能解释正电荷如何包含带负电荷的电子。换句话说,它不能解释原子的稳定性。
- 它未能解释卢瑟福的散射实验,也无法解释α粒子投射到金箔上时的散射。
汤姆森的模型是原子化学领域的一个突破。尽管它存在严重的缺陷,但它启发了该领域的其他研究人员进行实验并得出自己的结果和推论。
示例问题
问题1:根据汤姆逊原子模型,解释原子整体是中性的。
回答:
Thomson’s Atomic Model states that an atom is basically a positively charged sphere where the negatively charged electrons are implanted. The said charges, being equal in magnitude, cancel each other’s effect and neutralize the atom.
问题 2:解释汤姆森模型的主要缺点。
回答:
Although Thomson’s model was accepted at the time, it was discarded soon after because it failed to establish the stability of the atom, as it could not explain how the negative charge (electrons) is contained inside the positive sphere. In other words, it could not explain the presence of nucleus in the atom.
问题三:是什么导致了道尔顿原子论的失败?
回答:
According to Dalton’s atomic theory, all matter, whether an element, a compound or a mixture is composed of small particles called atoms. It states that all atoms are indivisible particles. But the discovery of two fundamental particles (electrons and protons) inside the atom, led to the failure of the aspect of Dalton’s atomic theory.
问题 4:陈述化学结合的规律。
回答:
Law of Conservation of Mass: It states that mass can neither be created nor destroyed in a chemical reaction, provided that the chemical system is cut off from all kinds of energy and heat from the outside. Therefore, the quantity of mass is conserved over time.
Law of Constant Proportions: It states that in a chemical substance the elements are always present in definite proportions by mass. It means that any pure sample of a compound will always consist of the same elements that are present in the same ratio by mass.
问题 5:JJ Thomson 是否发现了原子核?
回答:
J. J. Thomson, who discovered the electron in 1897, proposed the plum pudding model of the atom in 1904 before the discovery of the atomic nucleus in order to include the electron in the atomic model. He did not discover the atomic nucleus. It was discovered by another scientist, Epstein Rutherford during his tin foil experiment.
问题 6:你如何证明物质是由带电粒子组成的。
回答:
1. Comb dry hair and bring the comb near tiny bits of paper. We will observe that the paper bits would stick to the comb. Combing your dry hair will move some of the subatomic particles called electrons from hair to the comb. The charge of an electron is negative and thus the comb will also gain the charge of an electron (negative charge). Finally, when the comb is brought near the bits of paper, the bits of paper will get attracted to the comb.
2. Rub a silk cloth on a glass rod and then the glass rod is brought near an inflated balloon. The electrons from the glass rod are transferred to the silk cloth. Hence, the glass rod becomes positively charged. When the positively charged glass rod is brought near the inflated balloon, it will be attracted to the glass rod.
问题 7:是什么导致了电子的发现?
回答:
J.J. Thomson’s experiments with cathode ray tubes showed that all atoms contain tiny negatively charged subatomic particles or electrons. Thomson proposed the plum pudding model of the atom, which had negatively-charged electrons embedded within a positively-charged soup.