Ionic键和Ionic化合物
金属是天然存在于地球表面之下的矿物质或物质。大多数金属是有光泽的或闪闪发光的。金属是无机的,这意味着它们是由从未存在过的材料形成的。金属是地壳的天然成分,以金属矿石的形式存在,并与其他多种元素相互关联。它们也存在于被地表水和地下水冲刷的岩石中,以及空气尘埃中。非金属是接收或获得电子以产生负离子的物质。非金属的最外层通常有 4、5、6 或 7 个电子。
非金属是不具有金属所具有的所有特性的材料。它们非常擅长隔热和隔热。通常,它们是气体,但它们也可以是液体。例如,在室温下,碳、硫和磷是固体。
什么是Ionic键?
The ionic bond is the electrostatic force of attraction that holds two oppositely charged ions together.
一个或多个电子从一个原子到另一个原子的完全转移形成两个原子之间的化学连接,使原子获得最接近的惰性气体构型。两个原子结合以释放能量并变得稳定有三种主要方式。一种选择是通过捐赠或接受电子来完成它们的八位字节排列。离子键,也称为电价键,是由这种组合产生的。
Ionic键的性质:
由于阳离子和阴离子之间存在强大的吸引力,离子键合分子具有以下性质:
- Ionic键是所有键中最强大的。
- 离子键是正确介质中所有键中反应性最强的,因为它包含电荷分离。
- 离子结合化合物的熔点和沸点相当高。
- Ionic结合分子在其水溶液或熔融状态下是强电导体。这是因为存在充当电荷载体的离子。由于阳离子和阴离子之间存在强大的吸引力,在离子键合分子中发现了以下性质。
离子键的形成
离子键是通过电子从一个原子转移到另一个原子而形成的。在这种情况下,对于惰性气体构型,一个原子可以表示电子,而对于惰性气体构型,另一个原子需要电子。金属的外壳有 1,2,3 个电子,是捐赠的。金属在其外壳中接受具有 4、5、6、7 个电子的电子。
例如氯化钠的形成如下所示:
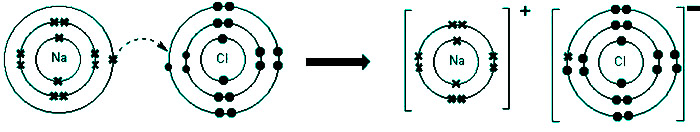
什么是Ionic化合物?
具有相反电荷的离子紧密堆积以形成结晶固体。当金属与非金属反应时,会产生离子化合物。
Ionic compounds are ionic compounds that have ionic bonds that bind them together. Elements can gain or lose electrons in order to obtain their closest noble gas configuration. Their stability is aided by the creation of ions for the completion of the octet (either by receiving or losing electrons).
在金属和非金属之间的反应中,金属失去电子以完成其八位字节,而非金属接收电子以完成其八位字节。当金属和非金属发生反应时,会产生离子化合物。结晶固体由具有相反电荷的离子紧密堆积在一起组成。当金属与非金属反应时会形成Ionic化合物。
Ionic化合物的结构
Ionic分子的结构由其阳离子和阴离子的相对大小决定。大多数无机化合物,包括盐、氧化物、氢氧化物和硫化物,都是离子化合物。Ionic固体通过正离子和负离子的静电相互作用结合在一起。
氯离子吸引钠离子,钠离子吸引氯离子。结果,Na +和 Cl -离子在三维框架中交替出现。这张照片中的晶体是氯化钠。晶体不带电,因为钠离子的数量等于氯离子的数量。离子之间存在的吸引力使它们保持在原位。带电粒子之间的离子相互作用形成大的离子结构。打破这些巨大复合物中的所有链接需要大量能量,因为离子紧密结合。因此,离子化合物具有高熔点和沸点。
Ionic化合物的性质
- 离子化合物的物理性质:Ionic化合物是由于正负离子之间的强烈吸引力而难以破碎的固体。当对它们施加压力时,它们通常会分裂成碎片,使它们变脆。
- 离子化合物的熔点和沸点:离子之间存在静电吸引力需要使用大量能量来破坏原子之间的离子键。因此,Ionic化合物具有高熔点和沸点。
- 离子化合物的溶解度:Ionic化学品一般可溶于水等极性溶剂,但在汽油、汽油和其他碳氢化合物等非极性溶剂中溶解度较低。
- 导电:在固态下,离子化合物不导电,但在熔融状态下,它们是极好的导体。电荷从一个点转移到另一个点就是电的传导方式。Ionic化合物在固态下不导电,因为离子迁移率不可行。Ionic化合物在熔融状态下导电,因为离子之间的静电吸引力被产生的热量所克服。
Ionic化合物的例子
在固态下,离子化合物不导电,但在熔融状态下,它们是极好的导体。电荷从一个点转移到另一个点就是电的传导方式。Ionic化合物在固态下不导电,因为离子迁移率不可行。Ionic化合物在熔融状态下导电,因为离子之间的静电吸引力被产生的热量所克服。
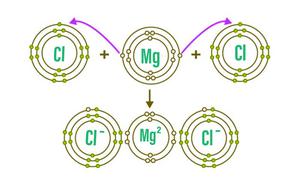
另一方面,氯原子在其最外层包含七个电子。结果,它只需要一个电子来完成它的八位字节。要成为镁离子,它可以从镁原子脱落的电子中获得这一电子。因为镁原子失去两个电子而氯原子只能得到一个电子,所以两个氯原子与一个镁原子结合生成镁。
示例问题
问题1:两种非金属进行离子连接是否可行?
回答:
Consider whether each element is a metal or a nonmetal to anticipate the type of bond that will form between them. Covalent bonds are formed by nonmetals, ionic bonds are formed by metals and nonmetals, and metallic bonds are formed by metals and metals in general.
问题二:为什么离子化合物的熔点那么高?
回答:
Ionic compounds have both positive and negative charges, which is why they are called ionic compounds. As a result, there will be a strong attraction between them. Because breaking this force of attraction requires a lot of heat, ionic compounds have high melting temperatures.
问题3:构成离子化合物的两种元素是什么?
回答:
Ionic compounds are made up of ions, which are charged particles that occur when an atom (or group of atoms) acquires or loses electrons. An anion is a negatively charged ion, while a cation is a positively charged ion.
问题4:如何打破离子键?
回答:
Because ionic compounds are polar, they dissolve in polar solvents like water. Polar solvents breakdown ionic bonds by disrupting them. The ionic bonds can be disrupted by dissolving the ionic material in water.
问题5:常见的离子化合物有哪些例子?
回答:
With high melting and boiling temperatures, ionic compounds appear to be both robust and fragile. Ions can be simple groupings of atoms, such as sodium and chlorine in table salt (sodium chloride), or more complex groupings, such as calcium carbonate.